题目内容
【题目】25℃时,Ka(CH3COOH)=1.7×10-5。该温度下,用0.1mol/L的醋酸滴定10.00 mL0.1mol/L的碱MOH,滴定过程中加入醋酸的体积(V) 与溶液中lg[C(H+)/c(OH-)]的关系如图所示。下列说法正确的是

A. MOH的电离方程式为MOH![]() M++OH-
M++OH-
B. a 点:V(CH3COOH)= 10.00mL
C. b点:c(CH3COO-)>c(H+ )>c(M+)>c(OH-)
D. 25℃,时,CH3COO-的水解平衡常数为(10/17)×10-9
【答案】D
【解析】A、由图象可知,开始时lg[c(H+)/c(OH-)]= -12,已知c(MOH)=0.1mol/L,溶液中c(OH-)= 0.1mol/L,则MOH为强碱,其电离方程式为MOH==M++OH-,故A错误;B、a点对应的lg[c(H+)/c(OH-)]=0,即c(H+)= c(OH-),溶液呈中性,由于醋酸是弱酸,当与一元强碱完全反应时溶液呈弱碱性,所以当溶液呈中性时,醋酸溶液的体积大于10.00mL,故B错误;C、b点的溶液中,溶质为等物质的量浓度的醋酸CH3COOH和醋酸盐CH3COOM,由于醋酸电离程度很小,所以溶液中c(H+)< c(M+),正确的关系为c(CH3COO-))>c(M+)> c(H+)> c(OH-),故C错误;D、25℃时,Ka(CH3COOH)=1.7×10-5,KW=1.0×10-14,所以CH3COO-的水解平衡常数Kh=![]() =
=![]() = (10/17)×10-9,所以D正确。本题正确答案为D。
= (10/17)×10-9,所以D正确。本题正确答案为D。

【题目】甲酸(HCOOH)是还原性酸,又称作蚁酸,常用于橡胶、医药、染料、皮革等工业生产。某化学兴趣小组在分析甲酸的组成和结构后,对甲酸的某些性质进行了探究。请回答下列问题。
I.甲酸能与醇发生酯化反应
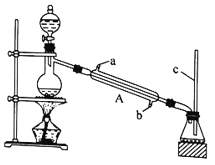
该兴趣小组用如上图所示装置进行甲酸(HCOOH)与甲醇(CH3OH)的酯化反应实验:
有关物质的性质如下:
沸点/℃ | 密度(g·cm-3) | 水中溶解性 | |
甲醇 | 64.5 | 0.79 | 易溶 |
甲酸 | 100.7 | 1.22 | 易溶 |
甲酸甲酯 | 31.5 | 0.98 | 易溶 |
(1)装置中,仪器A的名称是_________________,长玻璃管c的作用是__________________________。
(2)甲酸和甲醇进行酯化反应的化学方程式为____________________________________________。
(3)要从锥形瓶内所得的混合物中提取甲酸甲酯,可采用的方法为__________________________________。
II.甲酸能脱水制取一氧化碳

(1)利用上图装置制备并收集CO气体,其正确的连接顺序为a→__________(按气流方向从左到右,用小写字母表示)。
(2)装置B的作用是__________________________________。
(3)一定条件下,CO能与NaOH固体发生反应:CO+NaOH ![]() HCOONa。
HCOONa。
①为了证明“CO与NaOH固体发生了反应”,设计下列定性实验方案:取固体产物,配成溶液,___________。
②测定产物中甲酸钠(HCOONa)的纯度:准确称取固体产物8,0g配制成100mL溶液,量取20.00mL该溶液于锥形瓶中,再加入___________作指示剂,用1.5mol/L的盐酸标准溶液滴定剩余的NaOH,平行滴定三次,平均消耗盐酸的体积为5.05mL,则产物中甲酸钠的质量分数为_______(计算结果精确到0.1%)。