题目内容
12.V2O3和V2O5按不同物质的量之比混合可按化学计量数发生完全反应:xV2O5+yV2O3=zVnO2N+1①若反应物的物质的量之比x:y为2:1,可得到V6O13
②若反应物的物质的量之比x:y为5:1,可得到V3O7.
分析 设出V2O3和V2O5的物质的量,分别根据反应产物的化学式列式计算出二者的物质的量之比.
解答 解:①设V2O5的物质的量为x,V2O3的物质的量为y,由原子守恒,则:
所以(2x+2y):(5x+3y)=6:13,解之得x:y=2:1,
故答案为:2:1;
②设V2O5的物质的量为x,V2O3的物质的量为y,由原子守恒,则:
所以(2x+2y):(5x+3y)=3:7,解之得x:y=5:1,
故答案为:5:1.
点评 本题考查了混合物的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握质量守恒在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
2. 如图是用高纯度固体二氧化钛生产金属钛的装置示意图,其原理是在较低的电压下,二氧化钛中的氧电离而进入熔融的氯化钙中,最后该电极只剩下纯净的金属钛.已知:熔融状态下,放电强弱为O2->Cl-.下列有关说法正确的是( )
如图是用高纯度固体二氧化钛生产金属钛的装置示意图,其原理是在较低的电压下,二氧化钛中的氧电离而进入熔融的氯化钙中,最后该电极只剩下纯净的金属钛.已知:熔融状态下,放电强弱为O2->Cl-.下列有关说法正确的是( )
 如图是用高纯度固体二氧化钛生产金属钛的装置示意图,其原理是在较低的电压下,二氧化钛中的氧电离而进入熔融的氯化钙中,最后该电极只剩下纯净的金属钛.已知:熔融状态下,放电强弱为O2->Cl-.下列有关说法正确的是( )
如图是用高纯度固体二氧化钛生产金属钛的装置示意图,其原理是在较低的电压下,二氧化钛中的氧电离而进入熔融的氯化钙中,最后该电极只剩下纯净的金属钛.已知:熔融状态下,放电强弱为O2->Cl-.下列有关说法正确的是( )| A. | a电极为阴极 | |
| B. | a电极产生的气泡中主要成分是氯气 | |
| C. | 通电时,O2-、Cl-等向阴极移动 | |
| D. | 该制备工艺中需要定期更换石墨棒 |
3.在FeCl3和CuCl2的混合溶液中加入铁屑,若反应结束后铁有剩余,下列说法正确的是( )
| A. | 溶液中一定存在Fe2+ | B. | 溶液中一定存在Fe3+ | ||
| C. | 溶液中一定存在Cu2+ | D. | 溶液中一定不存在Fe2+ |
20.下列所陈述的事实与解释均正确的是( )
| 选项 | 实验操作及现象 | 实验结论 |
| A | 用pH试纸测定NaClO溶液的酸碱性,试纸显蓝色 | NaClO水解显碱性 |
| B | 收集铜与浓硝酸反应生成的气体,用冰水混合物冷却降温,气体颜色变浅 | 生成的红棕色NO2气体部分转化为无色气体 |
| C | 向某溶液中加入几滴新制的氯水,再加入2滴KSCN溶液,溶液变为红色 | 原溶液中一定含有Fe2+ |
| D | 甲苯能使酸性高锰酸钾溶液褪色 | 发生了萃取 |
| A. | A | B. | B | C. | C | D. | D |
7.常温下,下列各组微粒在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol/L AgNO3溶液:H+、K+、SO42-、I- | |
| B. | 加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- | |
| C. | 甲基橙呈红色的溶液中:MnO4-、Al3+、C2H5OH、SO42- | |
| D. | $\frac{{K}_{W}}{C({H}^{+})}$=0.1mol/L的溶液:K+、Na+、SiO32-、NO3- |
4.在其他条件一定时,对反应2A+B2C(正反应放热),A的最大转化率与温度曲线如图,下列叙述正确的( )
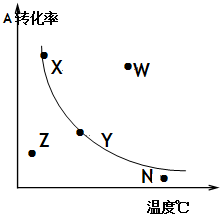

| A. | X或Y两点相应的V正≠V逆 | |
| B. | X、Y两点均已到达平衡状态两点的反应速率均有V正=V逆 | |
| C. | W点表示非平衡状态且V正>V逆 | |
| D. | 相应点的反应速率大小:W>N>Y |
2.下列指定反应的离子方程式不正确的是( )
| A. | 醋酸钠溶液可使酚酞试液变红:CH3COO-+H2O?CH3COOH+OH- | |
| B. | NaHS水解:HS-+H2O═S2-+H3O+ | |
| C. | 向NaAlO2溶液中通入过量CO2:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- | |
| D. | 向AgCl的悬浊液中滴入少量Na2S溶液:2AgCl+S2-═Ag2S+2Cl- |
