题目内容
7.常温下,下列各组微粒在指定溶液中一定能大量共存的是( )| A. | 0.1 mol/L AgNO3溶液:H+、K+、SO42-、I- | |
| B. | 加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- | |
| C. | 甲基橙呈红色的溶液中:MnO4-、Al3+、C2H5OH、SO42- | |
| D. | $\frac{{K}_{W}}{C({H}^{+})}$=0.1mol/L的溶液:K+、Na+、SiO32-、NO3- |
分析 A.银离子与硫酸根离子、碘离子发生反应;
B.加入苯酚显紫色的溶液中存在铁离子,铁离子能够氧化碘离子;
C.甲基橙呈红色的溶液显酸性,高锰酸根离子、乙醇在酸性条件下发生氧化还原反应;
D.该溶液为碱性溶液,四种离子之间不反应,都不与氢氧根离子反应.
解答 解:A.Ag+与SO42-、I-结合生成沉淀,不能大量共存,故A错误;
B.加入苯酚显紫色的溶液中含Fe3+,Fe3+与I-发生氧化还原反应,不能大量共存,故B错误;
C.甲基橙呈红色的溶液显酸性,MnO4-、C2H5OH发生氧化还原反应,不能大量共存,故C错误;
D.该溶液中氢氧根离子浓度0.1mol/L,溶液显碱性,K+、Na+、SiO32-、NO3-之间不反应,可大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
相关题目
3.由FeO、Fe2O3、Fe3O4组成的混合物,测得其中铁元素与氧元素的质量比为21:8,则这种混合物中FeO、Fe2O3、Fe3O4的物质的量之比可能为( )
| A. | 1:2:1 | B. | 1:2:3 | C. | 1:3:1 | D. | 1:1:3 |
15.下列叙述正确的是( )
| A. | 1.00mol NaCl中含有6.02×1023个NaCl分子 | |
| B. | 1.00mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023 | |
| C. | 欲配置1.00L,1.00mol.L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中 | |
| D. | 电解58.5g 熔融的NaCl,能产生22.4L氯气(标准状况)、23.0g金属钠 |
2.下列进行性质比较的实验,不合理的是( )
| A. | 比较Cu、Fe的还原性:铜加入硫酸铁溶液中 | |
| B. | 比较镁、铝的金属性:取一小段去氧化膜的镁带和铝片,分别加入1.0 mol•L-1的盐酸中 | |
| C. | 比较高锰酸钾、氯气的氧化性:高锰酸钾中加入浓盐酸 | |
| D. | 比较氯、溴的非金属性:溴化钠溶液中通入氯气 |
16.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 分别用H2O2、KMnO4分解制O2,当制得等质量O2时,转移电子数之比为1:1 | |
| B. | 常温下,0.1 mol•L-1 NH4NO3溶液中含有的氮原子数是0.2NA | |
| C. | 常温常压下,3.2 g O2和3.2 g O3所含氧原子数都是0.2NA | |
| D. | 1mol 甲基所含电子数约为10NA |
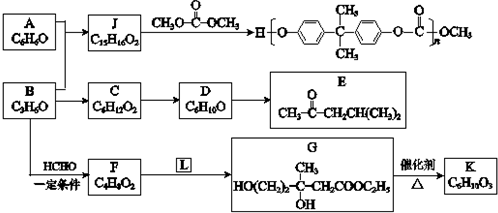
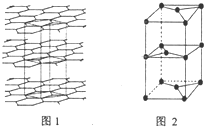 A、B、C、D、E、F、G为前四周期元素.A、B最外层电子排布可表示为asa、bsbbpb(a≠b);C元素对应单质是空气中含量最多的物质;D的最外层电子数是内层电子数的3倍;E与D同主族,且位于D的下一周期;F与E同周期,且是本周期中电负性最大的元素:基态G原子核外电子填充在7个能级中,且价层电子均为单电子.
A、B、C、D、E、F、G为前四周期元素.A、B最外层电子排布可表示为asa、bsbbpb(a≠b);C元素对应单质是空气中含量最多的物质;D的最外层电子数是内层电子数的3倍;E与D同主族,且位于D的下一周期;F与E同周期,且是本周期中电负性最大的元素:基态G原子核外电子填充在7个能级中,且价层电子均为单电子. .
.
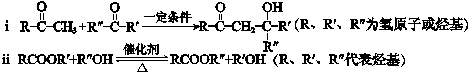
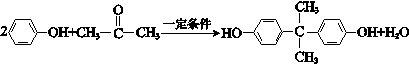 ,.
,.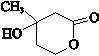 ,
,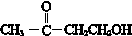 ,
,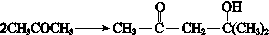 ,
,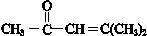 .
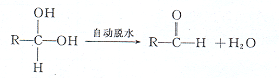
.
 .
. 、
、 .
.