题目内容
金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(S/ mol·L-1)如图所示。
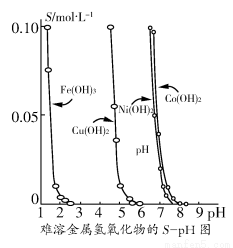
(1)pH=3时溶液中铜元素的主要存在形式是________。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH________。
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,________(填“能”或“不能”)通过调节溶液pH的方法来除去,理由是__________________________。
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以加入氨水生成[Cu(NH3)4]2+,写出反应的离子方程式:________________________。
(5)已知一些难溶物的溶度积常数如下表:
物质 | FeS | MnS | CuS |
Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-35 |
物质 | PbS | HgS | ZnS |
Ksp | 3.4×10-28 | 6.4×10-33 | 1.6×10-24 |
为除去某工业废水中含有的Cu2+、Pb2+、Hg2+杂质,最适宜向此工业废水中加入过量的________。
A.NaOH B.FeS C.Na2S
(1)Cu2+ (2)B (3)不能 Co2+和Ni2+沉淀的pH范围相差太小 (4)Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O (5)B
【解析】由图可知,在pH=3时溶液中不会出现Cu(OH)2沉淀。
(2)要除去Fe3+的同时必须保证Cu2+不能沉淀,因此pH应保持在4左右。
(3)从图示关系可看出,Co2+和Ni2+沉淀的pH范围相差太小,不能通过调控pH而达到分离的目的。
(4)Cu(OH)2(s) Cu2+(aq)+2OH-(aq),加入氨水后生成难电离的[Cu(NH3)4]2+,促进Cu(OH)2的溶解。
Cu2+(aq)+2OH-(aq),加入氨水后生成难电离的[Cu(NH3)4]2+,促进Cu(OH)2的溶解。
(5)要使三种离子生成沉淀,最好选择难溶于水的FeS,使三种杂质离子转化为更难溶解的金属硫化物沉淀,同时又不会引入其他离子。