题目内容
(1)1 mol分子组成为C3H8O的液态有机物A,与足量的金属钠作用,可生成11.2 L(标准状况)氢气,则A分子中必有一个 基,若此基在碳链的一端,且A中无支链,则A的结构简式为 。
(2)A与浓硫酸共热,分子内脱去1分子水,生成B,B的结构简式为 ;B通入溴水中能发生 反应,生成C,C的结构简式为 。
(3)A在铜作催化剂时,与氧气在加热条件下发生氧化还原反应生成D,D的结构简式为 。
写出下列指定反应的化学方程式:
①A→B ;
②B→C ;
③A→D 。
(1)羟;CH3CH2CH2OH
(2)CH3—CH—CH2;加成;CH3CHBr—CH2Br
(3)CH3CH2CHO
①CH3CH2CH2OH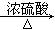 CH3CH—CH2↑+H2O
CH3CH—CH2↑+H2O
②CH3CH—CH2+Br2―→CH3CHBr—CH2Br
③2CH3CH2CH2OH+O2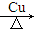 2CH3CH2CHO+2H2O
2CH3CH2CHO+2H2O
【解析】A的分子式符合通式CnH2n+2O,又能与金属钠作用产生H2,因此A是饱和一元醇,含有一个羟基,且羟基在碳链的一端,A中无支链,所以A的结构简式为CH3CH2CH2OH,A发生消去反应生成B:CH3CH—CH2,B能与溴水发生加成反应;A在铜作催化剂时能被氧气氧化为CH3CH2CHO。

 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(S/ mol·L-1)如图所示。
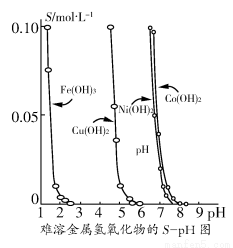
(1)pH=3时溶液中铜元素的主要存在形式是________。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH________。
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,________(填“能”或“不能”)通过调节溶液pH的方法来除去,理由是__________________________。
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以加入氨水生成[Cu(NH3)4]2+,写出反应的离子方程式:________________________。
(5)已知一些难溶物的溶度积常数如下表:
物质 | FeS | MnS | CuS |
Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-35 |
物质 | PbS | HgS | ZnS |
Ksp | 3.4×10-28 | 6.4×10-33 | 1.6×10-24 |
为除去某工业废水中含有的Cu2+、Pb2+、Hg2+杂质,最适宜向此工业废水中加入过量的________。
A.NaOH B.FeS C.Na2S


