题目内容
【题目】2017年5月海底天然气水合物(俗称“可燃冰”)试采成功,这是我国能源开发的一次历史性突破。一定条件下,CH4和CO2都能与H2O形成如下图所示的笼状结构(表面的小球是水分子,内部的大球是CH4分子或CO2分子;“可燃冰”是CH4与H2O形成的水合物),其相关参数见下表。
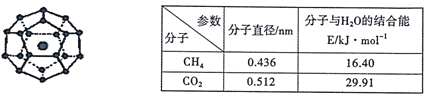
(1)CH4和CO2所含的三种元素电负性从大到小的顺序为_______;碳原子的最高能级的符号是_______,其电子云形状是_______。
(2)CO2分子中碳原子的杂化轨道类型为_______,分子的立体构型为_____。CO2与SO2相同条件下在水中的溶解度较大的是SO2,理由是________。
(3)为开采海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是_______。
(4)“可燃冰”中分子间存在的作用力是氢键和_________,上图中最小的环中连接的原子总数是_______。
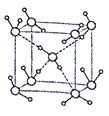
(5)水在不同的温度和压力条件下可形成11种不同结构的晶体,密度从比水轻的0.92g/cm3到约为水的1.5 倍。冰是人们迄今已知的由一种简单分子堆积出结构花样最多的化合物。其中冰- Ⅶ的晶体结构为一个如图所示的立方晶胞,每个水分子与周围4个水分子以氢键结合。设O-H…O距离为apm,阿伏加德罗常数的值为NA,则该冰- Ⅶ晶体的密度为____ g/cm3(列出计算式即可)。
【答案】 O>C>H 2p 哑铃形 sp 直线型 SO2为极性分子,CO2为非极性分子,H2O为极性溶剂,极性分子易溶于极性溶剂,故SO2的溶解度较大 CO2的分子直径小于笼状空腔直径,且与H2O的结合力大于CH4 范德华力 10 
【解析】(1)一般来说,元素的非金属性越强,电负性越强,所以顺序为:O>C>H。碳为第6号元素,原子核外有6个电子,其最高能级为2p。p电子云的形状是哑铃形。
(2)根据价层电子对互斥理论,CO2的中心原子C的价电子对为2+(4-2×2)=2对,所以CO2的空间构型为直线型,C的杂化类型为sp杂化。CO2为直线型分子,所以是非极性分子,而SO2为折线形,所以是极性分子,根据相似相溶的原理,SO2在极性溶剂(水)中的溶解度更大。
(3)已知上图中笼状结构的空腔直径为0.586nm,根据上述图表,得到CO2分子的直径小于空腔直径,可以嵌入笼状结构中,同时二氧化碳与水分子的结合能高于甲烷,说明二氧化碳更易于与水结合,有可能将已经嵌入笼中的甲烷置换出来。
(4)分子之间存在的力除氢键以外,只可能是范德华力。图中最小的环是由5个水分子通过氢键构成的,其结构为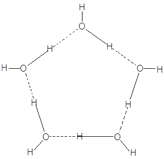 ,其中虚线代表氢键,实线代表共价键,所以最小的环中连接的原子为10个。
,其中虚线代表氢键,实线代表共价键,所以最小的环中连接的原子为10个。
(5)该晶胞中含有的水分子为:8×![]() + 1×1=2个,所以晶胞的质量为2×18÷NA=
+ 1×1=2个,所以晶胞的质量为2×18÷NA=![]() g。从图中得到O-H…O距离为该立方体晶胞的体对角线长度的一半,所以得到该晶胞的边长为
g。从图中得到O-H…O距离为该立方体晶胞的体对角线长度的一半,所以得到该晶胞的边长为![]() ,所以密度为
,所以密度为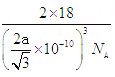 g/cm3。
g/cm3。

 阅读快车系列答案
阅读快车系列答案

