题目内容
【题目】氮化铝广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过以下反应合成:Al2O3+N2+3C![]() 2AlN+3CO。有关该反应下列叙述正确的是
2AlN+3CO。有关该反应下列叙述正确的是
A. AlN中氮的化合价为-3 B. 上述反应中,每消耗1 mol N2需转移3 mol电子
C. AlN的摩尔质量为41 g D. 上述反应中,N2是还原剂,Al2O3是氧化剂
【答案】A
【解析】
A.氮化铝中铝元素的化合价为+3价,根据化合物中各元素的正负化合价的代数和为分析;
B.氮元素从0价变为-3价,根据氮化铝和转移电子之间的关系分析;
C.根据摩尔质量的单位是g/mol分析。
D.在氧化还原反应中,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,据此分析;
A、氮化铝中Al的化合价为“+3”价,根据化合物中各元素的正负化合价的代数和为零计算,氮元素的化合价是“-3”价,故A正确;
B、N的化合价由“0”价变为“-3”价,故每消耗1 mol N2需转移6mol电子,故B错误;
C、氮化铝的摩尔质量是41g/mol,故C错误;
D、反应方程式可知,Al、O的化合价反应前后没有变化,N的化合价由“0”价变为“-3”价,而C的化合价由“0”价变为“+2”价,因此N2是氧化剂,Al2O3既不是氧化剂又不是还原剂,故D错误。
故选A。

【题目】大气中的氮氧化物(NOx)、CO、CO2、SO2 等的含量低高是衡量空气质量优劣的重要指标,对其研究和综合治理具有重要意义。
(1)汽车发动机工作时会引发N2和O2反应。已知:N2中氮氮键的键能是946kJ/mol,O2中氧氧键的键能是498kJ/mol,NO中氮氧键的键能是632kJ/mol。则N2和O2反应生成NO的热化学方程式为_____________。
(2)用CH4催化还原NOx可以消除污染:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(l)。若该反应在恒温恒容容器中达到平衡,下列叙述能作为判断反应达到平衡状态标志的是_____(填标号)。
N2(g)+CO2(g)+2H2O(l)。若该反应在恒温恒容容器中达到平衡,下列叙述能作为判断反应达到平衡状态标志的是_____(填标号)。
A.容器中的压强保持不变
B.容器中氮元素的质量分数不再变化
C.混合气体的平均相对分子质量不再变化
D.n(CH4):n(NO2):n(N2):n(CO2):n(H20)=1:2: 1: 1: 2
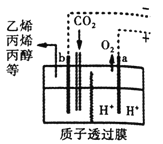
(3)为减少CO、CO2对环境造成的影响,采用以下方法将其资源化利用。
①在铝矾土作催化剂、773K条件下,3molCO与1.5molSO2反应生成3molCO2和0.75mol硫蒸气,该反应可用于从烟道气中回收硫,写出该反应的化学方程式_________。
②以CO2为原料采用特殊的电极电解强酸性的CO2水溶液可得到多种燃料,其原理如图所示。电解时其中b极上生成乙烯的电极反应式为_________。
(4)汽车尾气处理催化装置中涉及的反应之一为:2NO(g) +2CO(g)![]() N2(g) +2CO2(g) △H<0
N2(g) +2CO2(g) △H<0
研究表明:在使用等质量的催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某科研小组设计了以下三组实验:
实验编号 | T/K | NO初始浓度/(mol.L-1) | CO初始浓度/(mol.L-1) | 催化剂的比表面积(m2.g-1) |
Ⅰ | 400 | 1.00×10-3 | 3.60×10-3 | 82 |
Ⅱ | 400 | 1.00×10-3 | 3.60×10-3 | 124 |
Ⅲ | 450 | 1.00×10-3 | 3.60×10-3 | 124 |
(注:生成物的起始浓度为0mol/L)
根据下图回答:
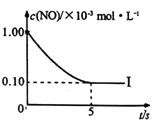
①实验I前5s内用N2 表示的反应速率为________。
②实验I反应的平衡常数KI=_______。
③在图中画出上表中实验Ⅱ、Ⅲ条件下混合气体中NO浓度随时间变化的趋势(标明各条曲线的实验编号) _____。
【题目】海洋是“聚宝盆”,工业上,人们直接从海水中得到食盐。海水在浓缩过程中析出盐类物质的种类和质量,如下表:
海水密度(g/L) | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
1.13 | 0.56 | ||||
1.20 | 0.91 | ||||
1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
(1)常采用____________的方法从海水中得到食盐。
(2)为得到含杂质较少的食盐,实际生产中卤水的密度控制在_____之间。
(3)粗盐中常含有MgCl2、MgSO4、CaCl2等杂质,通常在实验室中依次加入_________、__________、___________、___________等四种物质除去杂质。(填化学式)
(4)电解饱和食盐水可以制取氯气,同时得到几种重要的化工产品,
该反应的化学方程式为_________________________________________。通电时阳极产物是__________该产物的检验方法是___________________________________________
(5)电解过程中得到气体物质还可以化合为HCl,在实验室中我们利用_________________和_____________ 反应(写名称)来制取。该气体__________________溶于水,可以做喷泉实验。写出氯化氢气体溶于水后的电离方程式_____________________________________
(6)新制的氯水显_______色,这是因为氯水中有__________(填微粒符号)存在。向氯水中滴入几滴AgNO3溶液,观察到的现象是____________________________,发生变化的化学方程式为______________________________________________。蓝色石蕊试纸遇到氯水后的现象是___________________________,氯气有毒,不能直接排放到空气中,需要用________________________来吸收,写出反应的化学方程式为_________________________________________