题目内容
【题目】化学学习小组进行如下实验。
Ⅰ.探究反应速率的影响因素
设计了如下的方案并记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20mol·L-1H2C2O4溶液、0.010mol·L-1KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
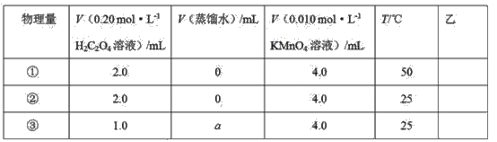
上述实验①、②是探究__对化学反应速率的影响;若上述实验②、③是探究浓度对化学反应速率的影响,则a为__;乙是实验需要测量的物理量,则表格中“乙”应填写__。
Ⅱ.测定H2C2O4·xH2O中x值
已知:M(H2C2O4)=90g·mol-1
①称取1.260g纯草酸晶体,将草酸制成100.00mL水溶液为待测液;
②取25.00mL待测液放入锥形瓶中,再加入适的稀H2SO4;
③用浓度为0.05000mol·L-1的KMnO4标准溶液进行滴定。
(1)请写出与滴定有关反应的离子方程式___。
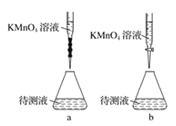
(2)某学生的滴定方式(夹持部分略去)如下,最合理的是___(选填a、b)。
(3)由图可知消耗KMnO4溶液体积为___mL,滴定管内剩余的液体的体积为___。

A.20.9 B.大于20.9 C.小于29.1 D.大于29.1
(4)滴定过程中眼睛应注视___,滴定终点的现象为___。
(5)通过上述数据,求得x=___。以标准KMnO4溶液滴定样品溶液的浓度,未用标准KMnO4溶液润洗滴定管,引起实验结果___(偏大、偏小或没有影响)。
【答案】温度 1.0 溶液褪色时间/s 5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O b 20.00 D 锥形瓶中溶液颜色变化 当滴入最后一滴KMnO4标准溶液时,溶液由无色变为浅紫色,且半分钟内不恢复原来的颜色 2 偏小
【解析】
Ⅰ.实验①②是在相同浓度,不使用催化剂,不同温度下进行的实验探究;上述实验②③是探究浓度对化学反应速率的影响,则混合液的总体积必须相同;反应速率需要通过时间的快慢来体现;
Ⅱ.(1)H2C2O4溶液和酸性KMnO4溶液反应生成二氧化碳、锰离子和水;
(2)据高锰酸钾呈酸性,盛放在酸式滴定管中来选择;
(3)根据滴定管的结构、精确度以及测量原理来解答;
(4)据滴定终点的判断是溶液中颜色的变化来分析;
(5)据此6H++5H2C2O4+2MnO4-=2Mn2++10CO2↑+8H2O离子方程式来计算;据滴定过程中眼睛应注视溶液中颜色变化,来判断滴定终点分析;根据 c(待测)=![]() 分析不当操作对V(标准)的影响,以此判断浓度的误差。
分析不当操作对V(标准)的影响,以此判断浓度的误差。
Ⅰ.实验①②是在相同浓度,不使用催化剂的条件下进行的,但反应温度不同,则为探究温度对速率的影响;而实验②④是在相同浓度、相同温度的条件下进行的,但②不使用催化剂,而④使用催化剂,则为探究催化剂对反应速率的影响;上述实验②③是探究浓度对化学反应速率的影响,则混合液的总体积必须相同,实验②溶液总体积为6mL,则实验③中所需水的体积a=25mL+4mL+2mL-25mL-4mL-1mL=1.0mL;反应速率需要通过时间的快慢来体现,则乙中需要测量的是溶液褪色所需时间,
故答案为:温度;1.0;溶液褪色所需时间;
Ⅱ.(1)H2C2O4溶液和酸性KMnO4溶液反应生成二氧化碳、锰离子和水,其反应的离子方程式为:6H++5H2C2O4+2MnO4-=2Mn2++10CO2↑+8H2O,
故答案为:6H++5H2C2O4+2MnO4-=2Mn2++10CO2↑+8H2O;
(2)高锰酸钾溶液呈酸性,应盛放在酸式滴定管中,
故答案为:b
(3)仪器A的名称是酸式滴定管;滴定管滴定前后读数为:0.80mL,20.80mL,消耗KMnO4溶液体积为20.80mL-0.80mL=20.00mL,滴定管下端有部分无刻度,滴定管内剩余的液体的体积大于大于29.1,故选D。
故答案为:20.00;D;
(4)据酸性KMnO4溶液为紫红色,滴定终点时无色变为紫红色,且半分钟不褪色为滴定到终点故眼睛应注视溶液中颜色变化,
故答案为:锥形瓶中颜色变色;溶液由无色变成紫红色,且半分钟内不褪色;
(5)
m(H2C2O4)=0.0025×90=0.225g; m(H2C2O4·xH2O )=1.26×![]() =0.315g; m(H2O)=0.315-0.225=0.09g;n(H2O)=
=0.315g; m(H2O)=0.315-0.225=0.09g;n(H2O)=![]() =0.005mol①
=0.005mol①
又因为 n H2C2O4)=0.0025 mol 根据元素守恒即n(H2C2O4·xH2O )=0.0025mol;n(H2O)=0.0025x②
联立①②得0.005=0.0025x,解得x=2;
未用标准KMnO4溶液润洗滴定管,溶液被稀释,造成V(标准)偏大,根据 c(待测)=![]() ,故c(待测)偏大,x偏小;
,故c(待测)偏大,x偏小;
故答案为:2;偏小。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案【题目】下列有关实验操作、现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 过量的Fe粉中加入HNO3, | 溶液呈红色 | 稀HNO3将Fe氧化为 |
B | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |