题目内容
已知蓄电池在放电时起原电池的作用,在充电时起电解池的作用。汽车上用的铅蓄电池是以一组充满海绵状灰铅的铅板和另一组结构相似的充满二氧化铅的铅板组成。两个电极用稀硫酸作电解质溶液。在放电时,两极发生的反应可分别表示为:
Pb+S-2e- PbSO4
PbSO4
PbO2+4H++S+2e- PbSO4+2H2O
PbSO4+2H2O
充电时,两极发生的反应分别表示为:
PbSO4+2e- Pb+S
Pb+S
PbSO4+2H2O-2e- PbO2+4H++S
PbO2+4H++S
在蓄电池放电时,溶液的pH将( )
| A.不变 | B.升高 | C.降低 | D.无法确定 |
B
解析

 活力课时同步练习册系列答案
活力课时同步练习册系列答案电化学在日常生活中用途广泛,图甲是镁一次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O=Cl-+Mg(OH)2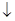 ,图乙是含Cr2O72-的工业废水的处理。下列说法正确的是
,图乙是含Cr2O72-的工业废水的处理。下列说法正确的是
A.图甲中发生的还原反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2 |
| B.图乙中Cr2O72-向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去 |
| C.图乙电解池中,若有0.084 g阳极材料参与反应,则阴极会有336 mL的气体产生 |
| D.若图甲燃料电池消耗3.6 g镁产生的电量用以图乙废水处理,理论上可产生10.7 g氢氧化铁沉淀 |
下图为某化工厂用石墨电解Na2CrO4溶液制备Na2Cr2O7的模拟装置,下列有关说法错误的是:
| A.溶液中OH-由阴极区流向阳极区 |
| B.阳极区产生的气体与阴极区产生的气体在相同状况下体积之比为1:2 |
| C.阳极的电极反应式为:2H2O-4e-=O2↑+4H+ |
| D.Na2CrO4转化为Na2Cr2O7的离子方程式为:2CrO42-+2H+= Cr2O72-+H2O |
将KCl和CuSO4两种溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图所示,则下列说法正确的是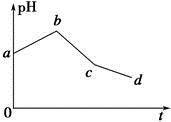
| A.整个过程中两电极反应2Cl--2e-=Cl2↑、2H++2e-=H2↑不可能同时发生 |
| B.电解至c点时,往电解液中加入适量CuCl2固体,即可使电解液恢复至原来的浓度 |
| C.ab段表示电解过程中H+被还原,pH上升 |
| D.原混合溶液中KCl和CuSO4的浓度之比恰好为2∶1 |
一种新型污水处理装置如图所示。该装置可利用一种微生物将有机废水的化学能直接转化为电能。下列说法中不正确的是
| A.电池工作时H+从M极区移向N极区 |
| B.N极为正极,发生还原反应 |
| C.M极的电极反应式为C6H12 O6 +6H2O-24e-=6CO2↑+24 H+ |
| D.当N极消耗5.6 L(标况下)气体时,则有2 NA个H+通过离子交换膜 |
固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆—氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是( )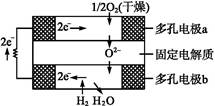
| A.有O2放电的a极为电池的负极 |
| B.有H2放电的b极为电池的正极 |
C.a极对应的电极反应为O2+2H2O+4e- 4OH- 4OH- |
D.该电池的总反应方程式为2H2+O2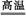 2H2O 2H2O |
如图所示,X为单质硅,Y为金属铁,a为NaOH溶液,组装成一个原电池,下列说法中正确的是( )
A.X为负极,电极反应为:Si-4e- Si4+ Si4+ |
B.X为正极,电极反应为:4H2O+4e- 4OH-+2H2↑ 4OH-+2H2↑ |
C.X为负极,电极反应为:Si+6OH--4e- Si+3H2O Si+3H2O |
D.Y为负极,电极反应为:Fe-2e- Fe2+ Fe2+ |
如图中,两电极上发生的电极反应如下:a极:Cu2++2e-=Cu;b极:Fe-2e-=Fe2+,则以下说法中不正确的是( )
| A.该装置一定是原电池 |
| B.a极上一定发生还原反应 |
| C.a、b可以是同种电极材料 |
| D.该过程中能量的转换可以是电能转化为化学能 |
小军利用家中的废旧材料制作了一个可使玩具扬声器发出声音的电池,装置如图所示。下列有关该电池工作时的说法错误的是( )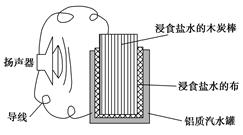
| A.铝质汽水罐将逐渐被腐蚀 |
| B.电子流向为铝质汽水罐→导线→扬声器→导线→木炭棒 |
| C.食盐水中的Na+向木碳棒移动 |
| D.木炭棒上发生的反应为2H++2e-=H2↑ |