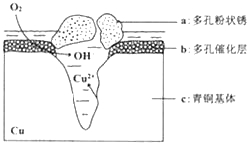
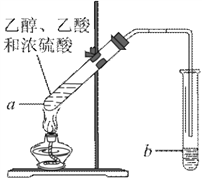
题目内容
【题目】电解质溶液的电导率越大,导电能力越强。用0.100 mol·L1的NaOH溶液分别滴定10.00 mL浓度均为0.100 mol·L1 的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是
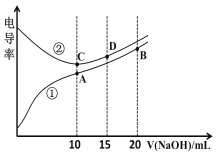
A.曲线①代表滴定HCl溶液的曲线
B.A点溶液中:c(CH3COO)+c(OH)c(H+)=0.1 molL1
C.在相同温度下,A、B、C三点溶液中水的电离程度:C<B<A
D.D点溶液中:2c(Na+)=3c(Cl)
【答案】D
【解析】溶液导电能力与离子浓度成正比,CH3COOH是弱电解质,溶液中离子浓度较小,导电能力弱,电导率小,随着NaOH溶液滴入,生成强电解质CH3COONa,溶液中离子浓度增大,溶液导电性增强;HCl是强电解质,随着NaOH溶液滴入,发生反应HCl+NaOH== NaCl+H2O,离子的总物质的量几乎没变,但溶液体积增大,导致溶液中离子浓度减小,溶液导电能力减弱,当恰好完全反应时离子浓度最小,继续加入NaOH溶液,离子浓度逐渐增大,溶液导电能力增强,对照图像可知,曲线②代表0.1 molL1 NaOH溶液滴定HC1溶液的滴定曲线,曲线①代表0.1 molL1NaOH溶液滴定CH3COOH溶液的滴定曲线。A.由分析可知,曲线①代表滴定CH3COOH溶液的曲线,故A错误;B.A点溶液中c(Na+)=0.05 molL1,根据电解质溶液中电荷守恒得c(CH3COO)+c(OH)c(H+)=c(Na+)= 0.05 molL1,故B错误;C.酸或碱抑制水电离,含有弱离子的盐促进水电离,C点溶质为NaCl,A点溶质为醋酸钠,促进水电离,B点为等物质的量浓度的醋酸钠和NaOH,NaOH抑制水的电离,所以在相同温度下,水的电离程度:B<C<A,故C错误;D.D点为15 mL 0.100 mol·L1NaOH溶液与10 mL10.00 mL盐酸的混合溶液,所以n(Na+):n(Cl)=3:2,即2c(Na+)=3c(Cl),故D正确。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案【题目】下表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
一 | ① | |||||||
二 | ② | ③ | ④ | ⑤ | ||||
三 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
四 | ⑩ |
(1)表中最活泼的金属是________,非金属性最强的元素是________(填元素符号);
(2)⑦的氢氧化物与⑥的最高价氧化物的水化物反应的化学方程式:
_____________________________________________________。
(3)⑧⑨两种元素形成的化合物的最高价含氧酸的酸性强弱顺序是⑧_____⑨。
(4)①③两种元素形成的化合物的水溶液显_____(填“酸”、“中”或“碱”)性。
(5)④⑧两种元素所形成的气态氢化物中较不稳定的是___________(用化学式表示)