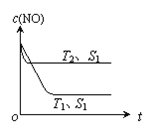
题目内容
【题目】结构简式是CH2=CHCH2CHO的物质不能发生( )
A.加成反应
B.还原反应
C.水解反应
D.氧化反应
【答案】C
【解析】解:因含C=C,能发生加成、氧化反应, 含﹣CHO,能发生加成、还原、氧化反应,
不能发生水解反应,
故选C.
【考点精析】根据题目的已知条件,利用有机物的结构和性质的相关知识可以得到问题的答案,需要掌握有机物的性质特点:难溶于水,易溶于汽油、酒精、苯等有机溶剂;多为非电解质,不易导电;多数熔沸点较低;多数易燃烧,易分解.

 名校课堂系列答案
名校课堂系列答案【题目】一定温度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示。
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:
①2Fe3++ H2O2 ![]() 2Fe2++O2↑+2H+
2Fe2++O2↑+2H+
② H2O2 + 2Fe2++2H+ ![]() 2H2O+2Fe3+
2H2O+2Fe3+
反应过程中能量变化如右图所示。下列说法不正确的是
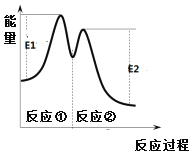
A. 0~6 min的平均反应速率:v(H2O2) = 3.33×10-2 mol·L-1·min-1
B. Fe3+的作用是加快过氧化氢的分解速率
C. 反应①是吸热反应、反应②是放热反应
D. 反应2H2O2(aq)![]() 2H2O(l) + O2(g)的△H =E1-E2 < 0
2H2O(l) + O2(g)的△H =E1-E2 < 0
【题目】Ⅰ.工业上以NH3、CO2为原料生产尿素[CO(NH2)2],该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
(1)写出工业上以NH3、CO2为原料合成尿素的热化学方程式:___________
(2)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:
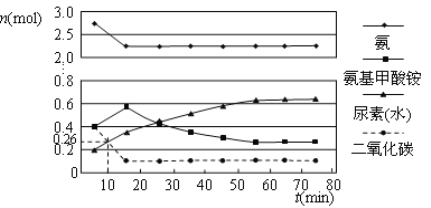
已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_________步反应决定,总反应进行到_________min时到达平衡。
Ⅱ.某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入酸性高锰酸钾溶液时,发现反应速率变化如图所示,小组成员探究t1~t2时间内速率变快的主要原因,为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种。
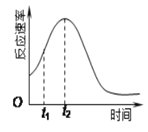
猜想Ⅰ:此反应过程放热,温度升高,反应速率加快;
猜想Ⅱ:……。
(3)猜想Ⅱ可能是:______________________
(4)基于猜想Ⅱ成立,设计方案进行实验,请完成以下实验记录表内容。
加入试剂 | 2mL0.1mol/L H2C2O4溶液、1mL 0.05mol/L 酸性KMnO4 | 2mL0.1mol/L H2C2O4溶液、 1mL 0.05mol/L 酸性KMnO4, 少量_______固体 |
实验现象 | 褪色时间10min | 褪色时间____10min (选填“<” “>”或 “=”) |
结论 | 猜想Ⅱ正确 | |