题目内容
【题目】(Ⅰ)汽车尾气是城市主要空气污染物,研究控制汽车尾气成为保护环境的重要任务。
(1)汽车内燃机工作时发生反应:N2(g) + O2(g)![]() 2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向一体积固定的密闭容器中充入6.5mol N2和7.5mol O2,在5 min时反应达到平衡状态,测得此时容器中NO的物质的量为5mol。
2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向一体积固定的密闭容器中充入6.5mol N2和7.5mol O2,在5 min时反应达到平衡状态,测得此时容器中NO的物质的量为5mol。
①反应开始至达到平衡的过程中,容器中下列各项发生变化的是___(填序号)。
a.混合气体的密度 b.混合气体的压强
c.正反应速率 d.单位时间内,N2和NO的消耗量之比
②假设容器体积为5L,则5min内该反应的平均速率υ(NO) =___;
(2)H2或CO可以催化还原NO以达到消除污染的目的。
①已知:N2(g) + O2(g) = 2NO(g) △H= +180.5 kJ·mol-1
2H2(g) + O2(g) = 2H2O(l) △H=-571.6 kJ·mol-1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是___;判断该反应自发进行的条件:___。
②当质量一定时,增大固体催化剂的表面积可提高化学反应速率。下图表示在其他条件不变时,反应:2NO(g) + 2CO(g)![]() 2CO2(g) + N2(g)中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。则该反应的△H___0(填“>”或“<”)。若催化剂的表面积S1>S2 ,在该图中画出c(NO)在T1、 S2条件下达到平衡过程中的变化曲线___。
2CO2(g) + N2(g)中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。则该反应的△H___0(填“>”或“<”)。若催化剂的表面积S1>S2 ,在该图中画出c(NO)在T1、 S2条件下达到平衡过程中的变化曲线___。
(3)某小组往一恒温恒压容器充入9mol N2和23mol H2模拟合成氨反应,图C为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图.若体系在T2、60MPa下达到平衡.

①能判断N2(g)+3H2(g)2NH3(g)达到平衡的是___(填序号).
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(N2)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②此时N2的平衡分压为__MPa.(分压=总压×物质的量分数)。计算出此时的平衡常数Kp=___(用平衡分压代替平衡浓度计算,结果保留2位有效数字)。
【答案】 c d 0.2 mol·L-1·min-1 2H2(g) + 2NO(g) = N2(g) + 2H2O(l) △H=-752.1 kJ·mol-1 低温自发 <  bd 9 0.043
bd 9 0.043
【解析】试题分析:本题考查盖斯定律的应用,化学反应自发性的判断,化学反应速率的计算,化学平衡图像的分析和作图,化学平衡状态的判断,化学平衡和化学平衡常数的计算。
(I)(1)①a项,该反应中所有物质全是气体,气体的总质量始终不变,容器的体积固定,混合气体的密度始终不变;b项,该反应是反应前后气体分子数不变的反应,从反应开始至达到平衡的过程中,气体物质的量始终不变,在体积固定的容器中混合气体的压强始终不变;c项,正反应速率随着时间的推移减小,平衡时保持不变;d项,随着时间的推移单位时间内N2的消耗量减小,随着时间的推移单位时间内NO的消耗量增大,随着时间的推移单位时间内N2和NO的消耗量之比减小;反应开始至达到平衡的过程中,容器中各项发生变化的是cd,答案选cd。
②根据题意,υ(NO)=![]() =0.2mol/(L·min)。
=0.2mol/(L·min)。
(2)①将两个反应编号,N2(g) + O2(g) = 2NO(g) △H= +180.5 kJ·mol-1(①式)
2H2(g) + O2(g) = 2H2O(l) △H=-571.6 kJ·mol-1(②式)
应用盖斯定律,②式-①式得,2H2(g)+2NO(g)=N2(g)+2H2O(l) ΔH=(-571.6kJ/mol)-(+180.5kJ/mol)=-752.1kJ/mol,反应的热化学方程式为:2H2(g)+2NO(g)=N2(g)+2H2O(l) ΔH=-752.1kJ/mol。该反应的ΔH![]() 0,ΔS
0,ΔS![]() 0,要使ΔG=ΔH-TΔS
0,要使ΔG=ΔH-TΔS![]() 0,该反应在低温下自发进行。
0,该反应在低温下自发进行。
②由图可见,T2、S1比T1、S1先出现拐点,T2、S1达到平衡的时间小于T1、S1达到平衡的时间,则T2![]() T1;T2、S1平衡时c(NO)大于T1、S1平衡时c(NO),温度升高NO浓度增大,平衡向逆反应方向移动,逆反应为吸热反应,正反应为放热反应,ΔH
T1;T2、S1平衡时c(NO)大于T1、S1平衡时c(NO),温度升高NO浓度增大,平衡向逆反应方向移动,逆反应为吸热反应,正反应为放热反应,ΔH![]() 0。根据题意:当质量一定时,增大固体催化剂的表面积可提高化学反应速率,若催化剂的表面积S1>S2,则T1、S2达到平衡的时间大于T1、S1;催化剂不能使化学平衡发生移动,T1、S2达到平衡时c(NO)与T1、S1平衡时相等;图像为
0。根据题意:当质量一定时,增大固体催化剂的表面积可提高化学反应速率,若催化剂的表面积S1>S2,则T1、S2达到平衡的时间大于T1、S1;催化剂不能使化学平衡发生移动,T1、S2达到平衡时c(NO)与T1、S1平衡时相等;图像为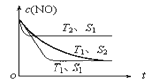 。
。
(3)①a项,在恒压容器中容器内的压强始终不变,容器内压强不再发生变化不能说明反应达到平衡状态;b项,混合气体的总质量始终不变,该气体的正反应为气体分子数减小的反应,建立平衡的过程中混合气体的物质的量减小,恒温恒压容器中混合气体的体积减小,混合气体的密度增大,平衡时混合气体的体积不再变化,混合气体的密度不再变化,混合气体的密度不再发生变化表明反应达到平衡状态;c项,达到平衡时3υ正(N2)=υ逆(H2),υ正(N2)=3υ逆(H2)反应没有达到平衡状态;d项,混合气体的总质量始终不变,该气体的正反应为气体分子数减小的反应,建立平衡的过程中混合气体的物质的量减小,混合气体的平均相对分子质量增大,平衡时混合气体的物质的量不变,混合气体的平均相对分子质量不再变化,混合气体的平均相对分子质量不再发生变化表明反应达到平衡状态;能说明反应达到平衡状态的是bd,答案选bd。
②用三段式,设开始到平衡转化N2物质的量为xmol
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
n(起始)(mol) 9 23 0
n(转化)(mol) x 3x 2x
n(平衡)(mol) 9-x 23-3x 2x
则![]() 100%=60%,解得x=6,则平衡时N2、H2、NH3物质的量依次为3mol、5mol、12mol,N2、H2、NH3物质的量分数依次为15%、25%、60%,则N2的平衡分压为60MPa
100%=60%,解得x=6,则平衡时N2、H2、NH3物质的量依次为3mol、5mol、12mol,N2、H2、NH3物质的量分数依次为15%、25%、60%,则N2的平衡分压为60MPa![]() 15%=9MPa。H2、NH3的平衡分压依次为15MPa、36MPa,平衡常数Kp=362
15%=9MPa。H2、NH3的平衡分压依次为15MPa、36MPa,平衡常数Kp=362![]() (9
(9![]() 153)=0.043。
153)=0.043。

 阅读快车系列答案
阅读快车系列答案