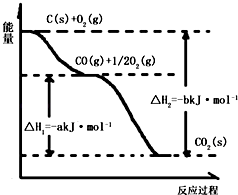
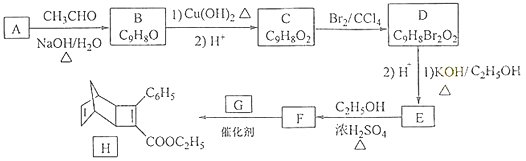
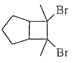
题目内容
【题目】(1)写出氯碱工业电解饱和食盐水的化学方程式:___________________________
(2)已知:2KMnO4 + 16HCl =2KCl+2MnCl2 +5Cl2↑+8H2O,15.8g KMnO4 与100mL12mol/L浓盐酸充分反应,固体完全溶解,生成标准状况下氯气的体积为________L,转移的电子数为_________个,若向反应后的溶液中加入足量的硝酸银,过滤、洗涤、干燥,可得到固体______g。
(3)将标准状况下6.72L的HCl溶于水形成250mL溶液,取出10mL于锥形瓶中,溶质的物 质的量浓度为______mol/L,向锥形瓶中滴加0.5mol/LBa(OH)2溶液,恰好反应,消耗Ba(OH)2的体积为__________mL。
【答案】 2NaCl + 2H2O![]() 2NaOH + H2↑ +Cl2↑ 5.6 0.5NA(或3.01×1023) 100.45 1.2 12
2NaOH + H2↑ +Cl2↑ 5.6 0.5NA(或3.01×1023) 100.45 1.2 12
【解析】(1). 在氯碱工业中,电解饱和食盐水生成NaOH、H2和Cl2,该反应的化学方程式为:2NaCl + 2H2O![]() 2NaOH + H2↑ +Cl2↑,故答案为:2NaCl + 2H2O
2NaOH + H2↑ +Cl2↑,故答案为:2NaCl + 2H2O![]() 2NaOH + H2↑ +Cl2↑;
2NaOH + H2↑ +Cl2↑;
(2). 15.8g KMnO4的物质的量为:15.8g÷158g/mol=0.1mol,与100mL12mol/L浓盐酸充分反应,固体完全溶解,根据反应方程式可知,生成氯气的物质的量为0.1mol×5/2=0.25mol,在标准状况下的体积为0.25mol×22.4L/mol=5.6L,在该反应中,Mn元素的化合价从+7价降低到+2价,所以0.1mol KMnO4完全反应转移电子的物质的量为0.1mol×(7-2)=0.5mol,个数为0.5NA或3.01×1023,100mL12mol/L的浓盐酸中含有HCl的物质的量为0.1L×12mol/L=1.2mol,与KMnO4反应后溶液中剩余Cl-的物质的量为1.2mol-2×n(Cl2)=1.2mol-2×0.25mol=0.7mol,向反应后的溶液中加入足量的硝酸银,生成AgCl沉淀的质量为0.7mol×143.5g/mol=100.45g,故答案为:5.6;0.5NA(或3.01×1023);100.45;
(3). 标准状况下6.72L HCl的物质的量为6.72L÷22.4L/mol=0.3mol,溶于水形成250mL溶液,HCl的物质的量浓度为:c(HCl)=0.3mol÷0.25L=1.2mol/L,取出10mL于锥形瓶中,向锥形瓶中滴加0.5mol/LBa(OH)2溶液,二者反应的化学方程式为:Ba(OH)2+2HCl=BaCl2+2H2O,根据方程式可知,恰好反应时,消耗Ba(OH)2的物质的量为0.01L×1.2mol/L÷2=0.006mol,体积为0.006mol÷0.5mol/L=0.012L=12mL,故答案为:1.2;12。

 初中暑期衔接系列答案
初中暑期衔接系列答案