题目内容
6.下列各制定粒子数目不等于阿伏伽德罗常数值的是( )| A. | 1gH2所含的原子个数 | |
| B. | 4g氮气所含的原子个数 | |
| C. | 16gO2所含的分子个数 | |
| D. | 23g金属Na全部转变为金属离子时失去的电子个数 |
分析 A、根据氢气由氢原子构成来分析;
B、根据氮气由氮原子构成来分析计算;
C、根据分子个数N=$\frac{m}{M}{N}_{A}$来计算;
D、求出钠的物质的量,然后根据反应后钠元素的价态为+1价来分析.
解答 解:A、氢气由氢原子构成,故1g氢气中的氢原子的物质的量n=$\frac{m}{M}$=$\frac{1g}{1g/mol}$=1mol,故氢原子的个数为NA个,故A不选;
B、氮气由氮原子构成,故4g氮气中含有的氮原子的物质的量n=$\frac{4g}{14g/mol}$=$\frac{2}{7}$mol,故氮原子的个数为$\frac{2}{7}{N}_{A}$个,故B选;
C、16g氧气中所含的氧气分子个数N=$\frac{m}{M}{N}_{A}$=$\frac{16g}{32g/mol}$NA=0.5NA个,故C选;
D、23g钠的物质的量为1mol,而反应后钠元素的价态为+1价,故1mol钠反应时失去1mol电子,个数为NA个,故D不选.
故选BC.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目
16.下列物质中,与0.3mol H2O含有相同氢原子数的物质是( )
| A. | 18.9 g HNO3 | B. | 3.612×1024个HCl分子 | ||
| C. | 0.2 mol H3PO4 | D. | 0.2 NA个CH4分子 |
17.(双选)下列化学反应中电子转移的表示方法正确的是( )
| A. | 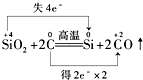 | |
| B. |  | |
| C. |  | |
| D. |  |
14.在2L容器中发生3A+B═2C的反应,最初加入的A、B都是4mol,A的反应速率为0.12mol/(L•s),10s后容器内的总物质的量为( )
| A. | 1.6 mol | B. | 2.8 mol | C. | 6.4 mol | D. | 3.6 mol |
1.对于反应Br2+SO2+2H2O=2HBr+H2SO4和2HBr+H2SO4(浓)=Br2+SO2↑+2H2O,下列说法中正确的是( )
| A. | 氧化性浓H2SO4>Br2,还原性:SO2>HBr | |
| B. | 它们互为可逆反应 | |
| C. | 反应条件的改变引起了反应方向的改变,它们都符合事实 | |
| D. | 它们相互矛盾,不可能符合事实 |
11.标准状况下,1mol下列物质体积最大的是( )
| A. | Fe | B. | O2 | C. | H2O | D. | H2SO4 |
18.下列说法正确的是( )
| A. | 水溶液中,1mol KCl和1mol KClO3电离出的氯离子一样多 | |
| B. | 电解质NaHCO3的电离方程式为:NaHCO3═Na++HCO3- | |
| C. | 凡溶于水后能电离出氢离子的化合物都是酸 | |
| D. | 氯化钠溶液在电流作用下,电离成自由移动的钠离子和氯离子 |
15.钠着火燃烧时,下列方法可以灭火的是( )
①泡沫灭火器 ②水 ③黄沙.
①泡沫灭火器 ②水 ③黄沙.
| A. | ① | B. | ①② | C. | ② | D. | ③ |
16.能将分别含有Cu2+、Fe3+、Al3+、Fe2+、Mg2+、NH4+、Na+等离子的七种溶液一次鉴别出来的试剂是( )
| A. | NaHCO3溶液 | B. | KSCN溶液 | C. | NaOH溶液 | D. | NH3•H2O溶液 |