题目内容
含硒(Se)的保健品已开始进入市场。已知硒与氧、硫同主族,与溴同周期,则下列关于硒的叙述中,正确的是( )
| A.非金属性比硫强 | B.氢化物比HBr稳定 |
| C.原子序数为34 | D.最高价氧化物的水化物显碱性 |
C
解析试题分析:氧、硫、硒为同主族元素。从上到下,随着原子序数的增大,元素的非金属性逐渐减弱。A.Se的原子序数不S大,所以非金属性比硫弱。错误。B.Br、Se是同一周期的元素,由于非金属性Se<Br,元素的非金属性越弱,其氢化物的稳定性就越差。所以氢化物不如HBr稳定。错误。C.S的原子序数为16,Se在S的下一周期。所以Se的原子序数为16+18=34。正确。D.Se是非金属元素,非金属元素的最高价氧化物对应的水化物的水溶液显酸性。错误。
考点:考查同一周期、同一主族的元素的单质及化合物的性质比较的知识。

练习册系列答案
相关题目
已知1~18号元素的离子aW3+、bX+、cY2—、dZ—都具有相同的电子层结构,下列关系正确的是( )
| A.质子数:c>d | B.离子的还原性:Y2—>Z — |
| C.氢化物的稳定性:H2Y>HZ | D.原子半径:X<W |
依据元素周期表及元素周期律,下列推断正确的是
| A.同周期主族元素的原子形成的简单离子电子层结构相同 |
| B.C比Si的原子半径小,CH4的稳定性比SiH4弱 |
| C.Na、Mg、Al失电子能力和其最高价氧化物对应的水化物的碱性均依次减弱 |
| D.在元素周期表金属与非金属的分界处可以寻找催化剂和耐高温、耐腐蚀的合金材料 |
已知某粒子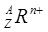 ,则元素R的原子序数是( )。
,则元素R的原子序数是( )。
| A.Z | B.A-Z | C.Z-n | D.Z+n |
甲、乙两种非金属性质比较:
①甲的单质熔、沸点比乙的低;
②甲单质能氧化乙原子的阴离子;
③最高价氧化物对应的水化物酸性比较,甲比乙的强;
④与金属反应时甲原子得电子的数目比乙多;
⑤甲单质比乙单质容易与氢气化合。
上述项目中能够说明甲比乙的非金属性强的是
| A.①②⑤ | B.③④⑤ | C.②③⑤ | D.②③④⑤ |
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示, 其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是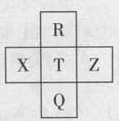
| A.非金属性:Z<T<X |
| B.R与Q的电子数相差26 |
| C.气态氢化物稳定性:R <T<Q |
| D.最高价氧化物的水化物的酸性:T>Q |
已知X、Y均为1~18号之间的元素,X、Y可形成化合物X2Y和X2Y2,又知Y的原子序数小于X的原子序数,则两种元素的原子序数之和为( )
| A.19 | B.18 | C.27 | D.9 |
钛(Ti)元素的同位素有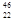 Ti
Ti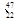 Ti
Ti Ti
Ti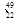 Ti
Ti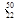 Ti,下列说法中不正确的是( )。
Ti,下列说法中不正确的是( )。
| A.上述同位素中,Ti原子核中的中子数不可能是30 |
| B.题述中包括5种钛元素,且质子数都是22 |
| C.题述中包括5种钛原子,即钛的5种核素 |
| D.钛的相对原子质量不可能为46,也不可能为50 |