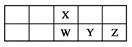
题目内容
已知1~18号元素的离子aW3+、bX+、cY2—、dZ—都具有相同的电子层结构,下列关系正确的是( )
| A.质子数:c>d | B.离子的还原性:Y2—>Z — |
| C.氢化物的稳定性:H2Y>HZ | D.原子半径:X<W |
B
解析试题分析:对于原子来说核内的质子数与核外的电子数相等。原子失去电子变为阳离子,原子获得电子变为阴离子。1~18号元素的离子aW3+、bX+、cY2—、dZ—都具有相同的电子层结构。A.则质子数:a>b>d> c。所以错误。B.对于电子层结构相同的微粒来说,核电荷数越大,离子半径就越小,离子失去电子的能力就越弱,所以还原性Y2—>Z —。正确。C.元素的非金属性越强,其对应的氢化物的稳定性就越强。非金属性:Z>Y,所以稳定性HZ> H2Y。错误。D.X、W是同一周期的元素,原子序数W>X。元素序数越大,原子半径就越小。因此原子半径:X>W。错误。
考点:考查具有相同的电子层结构的微粒的性质的知识。

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
元素在周围表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
| A.同一元素不可能既表现金属性,又表现非金属性 |
| B.第三周期主族元素的最高正化合价等于它所处的主族序数 |
| C.短周期元素形成离子后,最外层都达到8电子稳定结构 |
| D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
下列事实中,能说明氯的非金属性比硫强的是
| A.高氯酸的酸性比亚硫酸强 | B.次氯酸的氧化性比稀硫酸强 |
| C.氯化氢比硫化氢的热稳定性好 | D.氯原子最外层电子数比硫原子多 |
硼有两种天然同位素10B和11B,硼元素的相对原子质量为10.8,则10B与11B的物质的量之比为( )
| A.1∶4 | B.1∶2 | C.1∶1 | D.1∶3 |
短周期主族元素X、Y、Z、W的原子序数依次增大,原子半径:r(W)>r(Y)>r(Z)>r(X)。X与W同主族,Z原子最外层电子数是其内层电子总数的3倍,Z原子的核电荷数等于X、Y原子核电荷数之和。下列说法正确的是
| A.元素Z、W的简单离子的电子层结构不同 |
| B.元素Y的简单气态氢化物的热稳定性比Z的强 |
| C.仅由X、Y、Z三种元素形成的化合物的水溶液可能呈碱性 |
| D.化合物X2Z2与W2Z2所含化学键类型完全相同 |
含硒(Se)的保健品已开始进入市场。已知硒与氧、硫同主族,与溴同周期,则下列关于硒的叙述中,正确的是( )
| A.非金属性比硫强 | B.氢化物比HBr稳定 |
| C.原子序数为34 | D.最高价氧化物的水化物显碱性 |
下列有关元素的性质及其递变规律正确的是
| A.ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 |
| B.第二周期元素从左到右,最高正价从+1递增到+7 |
| C.同主族元素的简单阴离子还原性越强,水解程度越大 |
| D.同周期金属元素的化合价越高,其原子失电子能力越强 |
下列关于元素的叙述正确的是( )
| A.金属元素与非金属元素能形成共价化合物 |
| B.只有在原子中,质子数才与核外电子数相等 |
| C.目前使用的元素周期表中,最长的周期含有36种元素 |
| D.由非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8 |