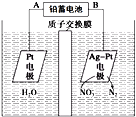
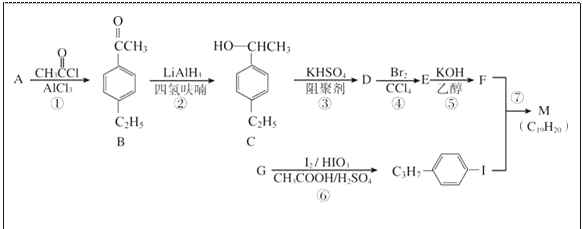
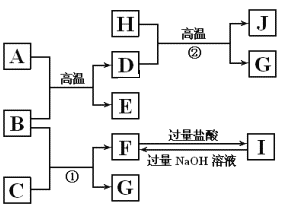
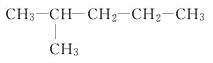题目内容
【题目】38.4gCu跟适量的浓HNO3反应,Cu全部反应后共收集到气体22.4L(标准状况),反应中作氧化剂的硝酸与总消耗的HNO3的物质的量比( )
A. 5∶11 B. 6∶11 C. 5∶6 D. 6∶5
【答案】A
【解析】
n(Cu)=![]() =0.6mol,n(气体)=
=0.6mol,n(气体)=![]() =1mol,由生成硝酸铜的物质的量可以知道表现酸性的硝酸的物质的量,由气体的物质的量可得被还原的硝酸的物质的量,以此计算反应消耗的硝酸的物质的量,计算反应中作氧化剂的硝酸与总消耗的HNO3的物质的量比。
=1mol,由生成硝酸铜的物质的量可以知道表现酸性的硝酸的物质的量,由气体的物质的量可得被还原的硝酸的物质的量,以此计算反应消耗的硝酸的物质的量,计算反应中作氧化剂的硝酸与总消耗的HNO3的物质的量比。
铜的物质的量为:n(Cu)=![]() =0.6mol,生成气体的物质的量为: n(气体)=
=0.6mol,生成气体的物质的量为: n(气体)=![]() =1mol,则被还原的硝酸的物质的量为1mol;
=1mol,则被还原的硝酸的物质的量为1mol;
则生成n[Cu(NO3)2]的物质的量为0.6mol,可以知道表现酸性的硝酸的物质的量为0.6mol![]() 2=1.2mol,
2=1.2mol,
所以参加反应的硝酸的物质的量为:1mol+1.2mol=2.2mol, 则反应中作氧化剂的硝酸与总消耗的HNO3的物质的量比为1mol:2.2mol=5:11,
所以A选项是正确的。

练习册系列答案
相关题目