题目内容
工业上用CH4和H2O为原料通过下列反应在一定条件下制备新型燃料甲醇,反应如下:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1
CO(g)+3H2(g) ΔH1
②CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
请按要求回答下列问题:
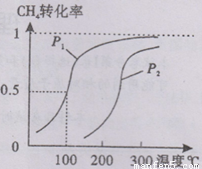
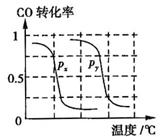
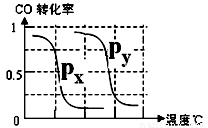
(1)将0.20 mol CH4和0.30 mol H2O(g)通入容积为2 L的密闭容器中,在一定条件下发生反应①,达到平衡时CH4的转化率与温度、压强的关系如下图.当温度不变缩小体积时此反应的逆反应速率(填“增大”、“减小”或“不变”)________;ΔH1________0,p1________p2(均填“<”、“=”或“>”);p1、100℃时平衡常数的值K=________.

(2)为了探究反应②合成甲醇适宜的温度和压强,某同学设计了以下三组实验,部分实验条件已经填在下面实验设计表中,请在空格中填入剩余的实验条件数据.

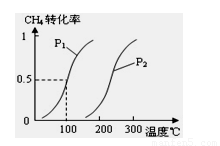
若在300℃时其他条件不变,将该反应容器容积压缩到原来的1/2,重新平衡时CH3OH的物质的量的变化是________,K的变化是________(均填“增大”,“减小”或“不变”).
(3)已知在常温常压下:2CH3OH(I)+3O2(g)![]() 2CO2(g) ΔH=-1275.6 kJ/mol
2CO2(g) ΔH=-1275.6 kJ/mol
H2O(g)=H2O(I) ΔH=-44.0 kJ/mol,请计算32 g新型燃料甲醇完全燃烧生成液态水放出热量为________kJ.
(4)新型燃料甲醇还可以用做燃烧电池,其反应原理如下图所示,电池工作时电子移动方向是(极板用M、N表示)________,负极电极反应式为________.

若以该燃料电池作为电源,用石墨作电极电解500 mL饱和食盐水,当两极共收集到1.12 L(标准状况下、不考虑气体的溶解及反应)时,常温下所得溶液的pH=________(假设反应前后溶液体积不变).

甲醇是一种很好的燃料,工业上用CH4和H2O 为原料,通过反应I和Ⅱ来制备甲醇。
⑴将1.0 mol CH4和2.0 mol H2O(g)通人反应室(容积为100L),在一定条件下发生反应:
CH4(g)+H2O(g) CO(g)+3H2(g)……I。CH4的转化率与温度、压强的关系如右图所示。
CO(g)+3H2(g)……I。CH4的转化率与温度、压强的关系如右图所示。
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 。
②图中的P1_ P2(填“<”、“>”或“=”),100℃时平衡常数为 。
③该反应的△H 0(填“<”、“>”或“=”)。
(2)在一定条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇: CO(g)+2H2(g) CH3OH(g)
△H<0 ……Ⅱ
CH3OH(g)
△H<0 ……Ⅱ
④若容器容积不变,下列措施可增加甲醇产率的是
A.升高温度 B.将CH3OH(g)从体系中分离
C.充人He,使体系总压强增大 D.再充人lmol CO和3 mol H2
⑤为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
A.下表中剩余的实验条件数据: a=_ ;b=_ 。
|
实验编号 |
T(℃) |
n(CO)/n(H2) |
P(Mpa) |
|
1 |
150 |
1/3 |
0.1 |
|
2 |
a |
1/3 |
5 |
|
3 |
350 |
b |
5 |
B.根据反应Ⅱ的特点,右下图是在压强分别为0.1 MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px = Mpa。

(8分)甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇。
请回答下列问题:
(1)将1.0molCH4和2.0molH2O(g)通入反应室(容积为l00L),在一定条件下发生反应:
cCH4(g)+H2O(g) 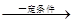 CO(g)+3H2(g)
I。
CO(g)+3H2(g)
I。
CH4的转化率与温度、压强的关系如图所示。
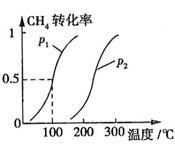
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数为 。
③该反应的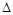 H
0。(填“<”、“>”或“=”)
H
0。(填“<”、“>”或“=”)
(2)在压强为0.1MPa条件下,a molCO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) CH30H(g)
CH30H(g) 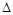 H<0 Ⅱ。
H<0 Ⅱ。
①若容器容积不变,下列措施可增加甲醇产率的是 (填序号)。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充人lmolCO和3 mol H2
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了下面的实验设计表中。
|
实验编号 |
T(℃) |
n(CO)/n(H2) |
p(MPa) |
|
l |
150 |
1/3 |
0.1 |
|
2 |
n |
1/3 |
5 |
|
3 |
350 |
m |
5 |
a.上表中剩余的实验条件数据:n= ,m= 。
b.根据反应Ⅱ的特点,如图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强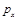 = MPa。
= MPa。
甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过反应Ⅰ和Ⅱ来制备甲醇。
⑴将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:
CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ。CH4的转化率与温度、压强的关系如上图。
CO(g)+3H2(g)……Ⅰ。CH4的转化率与温度、压强的关系如上图。
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 。
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数为 。
③该反应的△H 0(填“<”、“>”或“=”)。
⑵在压强为0.1 MPa条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) CH3OH(g);△H<0……Ⅱ。
CH3OH(g);△H<0……Ⅱ。
④若容器容积不变,下列措施可增加甲醇产率的是 。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
⑤为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
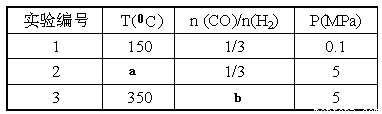
A.则上表中剩余的实验条件数据:a=________、b=_______。
B.根据反应Ⅱ的特点,右上图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=_________MPa。
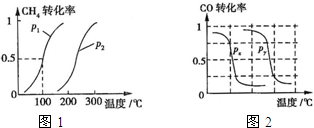 (2013?江西模拟)甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过下述反应Ⅰ和Ⅱ来制备甲醇.
(2013?江西模拟)甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过下述反应Ⅰ和Ⅱ来制备甲醇. 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应Ⅰ和Ⅱ来制备甲醇.请回答下列问题:
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应Ⅰ和Ⅱ来制备甲醇.请回答下列问题: