��Ŀ����
�״���һ�ֺܺõ�ȼ�ϣ���ҵ����CH4��H2O Ϊԭ�ϣ�ͨ����ӦI�͢����Ʊ��״���
�Ž�1.0 mol CH4��2.0 mol H2O(g)ͨ�˷�Ӧ��(�ݻ�Ϊ100L)����һ�������·�����Ӧ:
CH4(g)��H2O(g) CO(g)��3H2(g)����I��CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
CO(g)��3H2(g)����I��CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
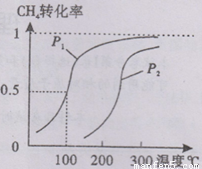
����֪100��ʱ�ﵽƽ�������ʱ��Ϊ5min������H2��ʾ��ƽ����Ӧ����Ϊ ��
��ͼ�е�P1_ P2(�<������>����=��),100��ʱƽ�ⳣ��Ϊ ��
�۸÷�Ӧ�ġ�H 0(�<������>����=��)��
(2)��һ�������£���a mol CO��3a mol H2�Ļ�������ڴ������������Է���Ӧ���ɼ״�: CO(g)+2H2(g) CH3OH(g)
��H<0 ������
CH3OH(g)
��H<0 ������
���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���
A�������¶� B����CH3OH(g)����ϵ�з���
C������He��ʹ��ϵ��ѹǿ���� D���ٳ���lmol CO��3 mol H2
��Ϊ��Ѱ�Һϳɼ״����¶Ⱥ�ѹǿ������������ijͬѧ���������ʵ�飬����ʵ�������Ѿ���������ʵ����Ʊ��С�
A���±���ʣ���ʵ����������: a=_ ��b=_ ��
|
ʵ���� |
T���棩 |
n(CO)��n(H2) |
P(Mpa) |
|
1 |
150 |
1��3 |
0.1 |
|
2 |
a |
1��3 |
5 |
|
3 |
350 |
b |
5 |
B�����ݷ�Ӧ����ص㣬����ͼ����ѹǿ�ֱ�Ϊ0.1 MPa��5MPa��CO��ת�������¶ȱ仯������ͼ����ָ��ͼ�е�ѹǿPx = Mpa��

��14�֣���1����0.0030mol/(L��min) ��2�֣� �ڣ� ��2�֣�
2.25��10��4(mol/L)2��2�֣���д��λ���۷֣���λд����1�֣� �ۣ���2�֣�
��2����BD��2�֣�
��A.a��150��b��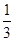 ����1�֣���2�֣� B.0.1��2�֣�
����1�֣���2�֣� B.0.1��2�֣�
��������
�����������1������ͼ���֪��ƽ��ʱ�����ת����Ϊ0.5�����Լ�������ʵ���������1.5mol��0.5��0.5mol�����c(CH4)��0.5mol��100L��0.005mol/L������v(CH4)��0.005mol/L��5min��0.001mol/��L•min��������֮�ȵ��ڻ�ѧ������֮�ȣ�����v(H2)��3v(CH4)��3��0.001mol/��L•min��=0.003mol/��L•min����
���¶���ͬʱ������ֱx��ĸ����ߣ�����ѹǿΪP1��CH4��ת���ʸߣ���ӦΪǰ���������ķ�Ӧ��ѹǿ����ƽ���������С�ķ����ƶ��������淴Ӧ�ƶ���CH4��ת���ʽ��ͣ�����P1��P2����
CH4��g���� H2O��g��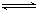 CO��g���� 3H2��g��
CO��g���� 3H2��g��
��ʼŨ�ȣ�mol/L�� 0.010 0.020 0 0
ת��Ũ�ȣ�mol/L�� 0.005 0.005 0.005 0.015
ƽ��Ũ�ȣ�mol/L�� 0.005 0.015 0.005 0.015
����ƽ�ⳣ��K��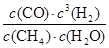 =
=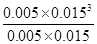 ��2.25��10-4��
��2.25��10-4��
����ͼ��֪���¶�Խ�����ת����Խ�������¶�ƽ��������Ӧ�����ƣ��¶�����ƽ�������ȷ����ƶ�����������ӦΪ���ȷ�Ӧ������H��0��
��2����A���÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ȷ����ƶ��������淴Ӧ�����ƶ����״��IJ��ʽ��ͣ���A����B����CH3OH��g������ϵ�з��룬�����Ũ�Ƚ��ͣ�ƽ��������Ӧ�ƶ����״��IJ������ӣ���B����C������He��ʹ��ϵ��ѹǿ���������ݻ����䣬��Ӧ���������Ũ�Ȳ��䣬ƽ�ⲻ�ƶ����״��IJ��ʲ��䣬��C����D���ٳ���1molCO��3molH2���ɵ�ЧΪѹǿ����ƽ���������С�ķ����ƶ�����������Ӧ�����ƶ����״��IJ������ӣ���D��ȷ����ѡBD��
��A����ȡ���Ʊ�������̽���ϳɼ״����¶Ⱥ�ѹǿ�����������������¶ȡ�ѹǿ�DZ仯�ģ�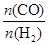 Ӧ���ֲ��䣬����b��
Ӧ���ֲ��䣬����b��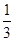 ���Ƚ�ʵ��1��2��֪��ѹǿ��ͬ�������¶�Ӧ��ͬ����a��150��
���Ƚ�ʵ��1��2��֪��ѹǿ��ͬ�������¶�Ӧ��ͬ����a��150��
B���¶���ͬʱ������ֱx��ĸ����ߣ�����ѹǿΪPy��CO��ת���ʸߣ���ӦΪǰ�������С�ķ�Ӧ��ѹǿ����ƽ���������С�ķ����ƶ�����������Ӧ�ƶ�������Px��Py�����ѹǿPx��0.1Mpa��
���㣺���鷴Ӧ���ʡ�ƽ�ⳣ���ļ��㣻���������ƽ��״̬��Ӱ���Լ�ͼ��ʶ���

 �������Ͽ�ʱͬ��ѵ��ϵ�д�
�������Ͽ�ʱͬ��ѵ��ϵ�д� �������ͬ����ϰϵ�д�
�������ͬ����ϰϵ�д�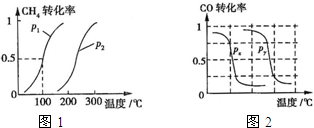 ��2013?����ģ�⣩�״���һ�ֺܺõ�ȼ�ϣ���ҵ����CH4��H2OΪԭ�ϣ�ͨ��������Ӧ��͢����Ʊ��״���
��2013?����ģ�⣩�״���һ�ֺܺõ�ȼ�ϣ���ҵ����CH4��H2OΪԭ�ϣ�ͨ��������Ӧ��͢����Ʊ��״��� CH3OH��g����H1=-116kJ?mol��1
CH3OH��g����H1=-116kJ?mol��1
 ��������ͼ����ָ��ͼ�е�ѹǿP1=
��������ͼ����ָ��ͼ�е�ѹǿP1= CO��g��+2H2��g����Ӧ��ƽ�ⳣ��Ϊ
CO��g��+2H2��g����Ӧ��ƽ�ⳣ��Ϊ �״���һ�ֺܺõ�ȼ�ϣ���ҵ����CH4��H2O��g��Ϊԭ�ϣ�ͨ����Ӧ��͢����Ʊ��״�����ش��������⣺
�״���һ�ֺܺõ�ȼ�ϣ���ҵ����CH4��H2O��g��Ϊԭ�ϣ�ͨ����Ӧ��͢����Ʊ��״�����ش��������⣺
 ��Ϊ��Ѱ�Һϳɼ״����¶Ⱥ�ѹǿ������������ijͬѧ���������ʵ�飬����ʵ�������Ѿ���������ʵ����Ʊ��С�
��Ϊ��Ѱ�Һϳɼ״����¶Ⱥ�ѹǿ������������ijͬѧ���������ʵ�飬����ʵ�������Ѿ���������ʵ����Ʊ��С�
 CO(g)+3H2(g)������
CO(g)+3H2(g)������
