题目内容
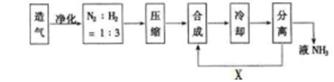
对于可逆反应N2(g)+3H2(g) 2NH3(g)(正反应为放热反应),下列说法中正确的是( )。
2NH3(g)(正反应为放热反应),下列说法中正确的是( )。
| A.达到平衡后加入N2,当重新达到平衡时,NH3的浓度比原平衡的大,H2的浓度比原平衡也大 |
| B.达到平衡后,升高温度,既加快了正、逆反应的速率,又提高了NH3的产率 |
| C.达到平衡后,缩小容器的体积,既有利于加快正、逆反应速率,又有利于提高氢气的转化率 |
| D.加入催化剂可以缩短达到平衡的时间,是因为正反应速率增大了,逆反应速率减小 |
C
解析

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列物质不能以食盐为原料而生产的是( )
| A.盐酸 | B.硫酸 | C.烧碱 | D.纯碱 |
化学与生产、生活、社会密切相关,下列有关说法中不正确的是 ( )
| A.神七宇航员所穿航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料 |
| B.食品包装袋、食物保鲜膜等材料的主要成份是聚氯乙烯 |
| C.人体内没有能使纤维素水解成葡萄糖的酶,因此纤维素不能作为人类的营养食物 |
| D.针对病毒性流感的扩散情况,要加强环境、个人等的消毒预防,其中消毒剂常选用含氯消毒剂、酒精、双氧水等适宜的物质 |
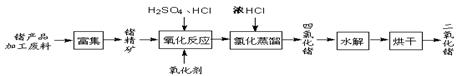
辉铜矿主要成分Cu2S,软锰矿主要成分MnO2,它们都含有少量SiO2、Fe2O3等杂质。工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如下:
已知:①MnO2能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀 的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):
| | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
(1)酸浸时,为了提高浸取率可采取的措施有 (任写一点)。
(2)酸浸时,得到的浸出液中主要含有CuSO4、MnSO4等。
写出该反应的化学方程式 。
(3)调节浸出液pH的范围为 ,其目的是 。
(4)本工艺中可循环使用的物质是 (写化学式)。
(5)在该工艺的“加热驱氨”环节,若加热的温度过低或过高,都将造成 的结果。
(6)用标准BaCl2溶液测定样品中MnSO4·H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有 (任写一种)。
如图所示是一种综合处理SO2废气的工艺流程,若每步都完全反应。下列说法正确的是 ( )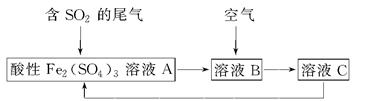
| A.溶液B中发生的反应为2SO2+O2=2SO3 |
| B.可用酸性高锰酸钾溶液检验溶液C中是否含有Fe3+ |
| C.由以上流程可推知氧化性:Fe3+>O2>SO42— |
| D.此工艺的优点之一是物质能循环利用 |
下列叙述中不属于土壤酸化原因的是( )。
| A.土壤胶体吸附的H+、Al3+被其他阳离子交换 |
| B.微生物、细菌在利用土壤中的有机物时,会产生二氧化碳和多种有机酸 |
| C.微生物、细菌在利用土壤中物质时,将土壤中的NH3转化为亚硝酸和硝酸,将硫化物转化为硫酸 |
| D.土壤有机物中的氮被微生物分解生成氨的氨化过程,会使土壤的pH升高 |
在接触法产生H2SO4的过程中,对“废气、废水、废渣、废热”的处理正确的是( )
①废气用氨水处理 ②污水用石灰乳处理 ③废渣用来造水泥或炼铁 ④设置“废热”锅炉产生蒸气来供热或发电
| A.只有①② | B.只有①③④ | C.只有①②③ | D.全部 |