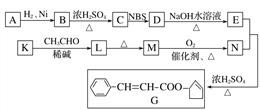
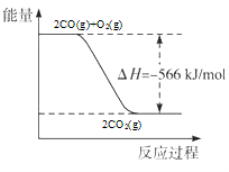
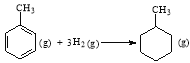题目内容
【题目】已知:
酸 | H2C2O4 | HF | H2CO3 | H2BO3 |
电离平衡常数Ka | Ka1=5.9×10-2 Ka2=6.4×10-5 | 未知 | Ka1=4.2×10-7 Ka2=5.6×10-11 | 5.8×10-10 |
(1)为了证明HF是弱酸,甲、乙、丙三位同学分别设计以下实验进行探究。
①甲同学取一定体积的HF溶液,滴入2滴紫色石蕊试液,显红色,再加入NaF固体观察到的现象是_______________,则证明HF为弱酸。
②乙同学取10ml未知浓度的HF溶液,测其pH为a,然后用蒸馏水稀释至1000ml。再测其pH为b,若要认为HF为弱酸,则a、b应满足的关系是b<_________(用含a的代数式表示)。
③丙同学用pH是指测得室温下0.10mol·L-1的HF溶液的pH为2,则测定HF为弱酸,由丙同学的实验数据可得室温下HF的电离平衡常数约为__________________。
(2)①已知H2BO3与NaOH溶液反应的离子方程式为H2BO3+OH-=B(OH)4,写出硼酸的电离方程式______________。
②向等浓度的H2C2O4与H2BO3混合溶液中逐滴加入NaOH溶液,则与OH-作用的粒子(包括分子和离子)依次为_____________,____________,____________。
③NaH C2O4溶液中加入少量的Na2CO3溶液,反应的离子方程式___________。
【答案】
(1)①红色变浅;②a+2③1.0x10-3
(2)①H2BO3+H2O![]() B(OH)4-+H+;②H2C2O4,HC2O4-、H2BO3;
B(OH)4-+H+;②H2C2O4,HC2O4-、H2BO3;
(3)2HC2O4+CO32-=2C2O42-+H2O+CO2↑
【解析】
试题分析:(1)①HF在溶液中电离出氢离子和氟离子,溶液显酸性,滴入2 滴紫色石蕊试液,显红色,再加入NaF 固体,HF的电离平衡向逆方向移动,氢离子浓度减小,溶液的红色变浅,证明HF存在电离平衡,即HF为弱酸;故答案为:红色变浅;
②乙同学取10ml未知浓度的HF 溶液,测其pH 为a,然后用蒸馏水稀释至1000mL,体积增大102倍,弱酸加水稀释会存进弱酸的电离,稀释102倍,pH变化小于2个单位,所以稀释后pH=b<a+2;故答案为:a+2;
③用pH 试纸测得室温下0.10molL-1的HF 溶液的pH为2,则c(H+)=0.01mol/L,则Ka=![]() =
=![]() ≈1.0×10-3;故答案为:1.0×10-3;
≈1.0×10-3;故答案为:1.0×10-3;
(2)①由信息可知为一元酸,H3BO3电离除生成B(OH)4-外还生成H+,其方程式为:H3BO3+H2O![]() B(OH)4-+H+,故答案为:H3BO3+H2O
B(OH)4-+H+,故答案为:H3BO3+H2O![]() B(OH)4-+H+;
B(OH)4-+H+;
②由表中数据可知,H2C2O4的第一电离和第二步电离程度都大于H3BO3,所以NaOH先与H2C2O4、HC2O4-反应,然后与H3BO3反应;故答案为:H2C2O4、HC2O4-、H3BO3;
(3)草酸的第二电离常数大于碳酸的第一电离常数,所以NaHC2O4 溶液中加入少量的Na2CO3溶液,会生成二氧化碳,其化学方程式为:2HC2O4-十CO32-=2C2O42-+H2O+CO2↑;故答案为:2HC2O4-十CO32-=2C2O42-+H2O+CO2↑。