题目内容
【题目】(1)0.2 mol NH3的质量为_____g,其中含有__个氨分子,氢原子的物质的量为______mol。
(2)质量相同的 CO2、NH3、SO2、O3 四种气体中,含有分子数目最多的是___________,在相同温度和相同压强条件下,体积最小的是____________。
(3)1.6g某气体含有 3.01×1022 个分子,该气体的摩尔质量为_________g/mol。
(4)把2.0 mol·L-1 Na2SO4溶液和1.0 mol·L-1 H2SO4 溶液等体积混合(假设混合后溶液的体积等于混合前两种溶液的体积之和),则SO![]() 的物质的量浓度为___________mol·L-1。
的物质的量浓度为___________mol·L-1。
【答案】3.4 1.204×1023 0.6 NH3 SO2 32 1.5
【解析】
(1)0.2 mol NH3的质量m(NH3)=![]() ;N(NH3)=
;N(NH3)=![]() ;1个氨分子中有3个氢原子,则1mol NH3中有3molH,0.2 mol NH3中氢原子的物质的量为0.6mol,故答案为:3.4;1.204×1023;0.6。
;1个氨分子中有3个氢原子,则1mol NH3中有3molH,0.2 mol NH3中氢原子的物质的量为0.6mol,故答案为:3.4;1.204×1023;0.6。
(2)由![]() 可知,质量一定时N与M成反比,质量相同的CO2、NH3、SO2、O3四种气体中摩尔质量最小的是氨气,则分子数最多的是氨气;由
可知,质量一定时N与M成反比,质量相同的CO2、NH3、SO2、O3四种气体中摩尔质量最小的是氨气,则分子数最多的是氨气;由![]() ,同温同压条件下,质量一定时,气体的体积与摩尔质量成反比,四种气体中二氧化硫的摩尔质量最大,故其体积最小,故答案为:NH3;SO2。
,同温同压条件下,质量一定时,气体的体积与摩尔质量成反比,四种气体中二氧化硫的摩尔质量最大,故其体积最小,故答案为:NH3;SO2。
(3)该气体的物质的量为:![]() ,
,![]() ,故答案为:32。
,故答案为:32。
(4)设两溶液体积各为1L,则混合后的溶液体积为2L,2.0 mol·L-1 Na2SO4溶液中的SO![]() 物质的量为
物质的量为![]() ,1.0 mol·L-1 H2SO4 溶液SO
,1.0 mol·L-1 H2SO4 溶液SO![]() 物质的量为
物质的量为![]() ,则SO
,则SO![]() 的物质的量浓度
的物质的量浓度![]() ,故答案为:1.5。
,故答案为:1.5。

【题目】用下图所示装置检验乙烯时不需要除杂的是( )

乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | 水 | Br2的CCl4溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | 水 | KMnO4酸性溶液 |
C | C2H5OH与浓H2SO4 | NaOH溶液 | KMnO4酸性溶液 |
D | C2H5OH与浓H2SO4 | NaOH溶液 | Br2的CCl4溶液 |
【题目】苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理:

己知甲苯的熔点为-95°C,沸点为110.6°C,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4°C,在25°C和95°C下溶解度分别为0.3g和6.9g。
【制备产品】将30.0mL甲苯和25.0mLlmol/L高锰酸钾溶液在100°C下反应30min,装置如图所示。
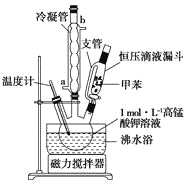
(1)图中冷凝管的进水口为________(填“a”或“b”)。支管的作用是___________。
(2)在本实验中,三领烧瓶最合适的容积___________(填字母)。
A.50mL | B.I00mL | C.200mL | D.250mL |
相对于用酒精灯直接加热,用沸水浴加热的优点是___________________。
【分离产品】该同学设计如下流程分离粗产品苯甲酸和回收甲苯
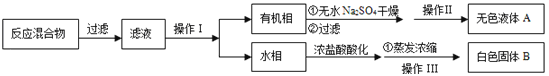
(3)操作Ⅰ的名称是 ;含有杂志的产物经操作Ⅱ进一步提纯得无色液体甲苯,则操作Ⅱ的名称是 。
(4)测定白色固体的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请完成表中内容。
序号 | 实验方案 | 实验现象 | 结论 |
① | 将白色固体加入水中,加热溶解,______。 | 得到白色晶体和无色溶液 | |
② | 取少重滤液于试管中,________。 | 生成白色沉淀 | 滤液含Cl- |
③ | 干燥白色晶体,________。 | _____________________ | 白色晶体是苯甲酸 |
纯度测定:称取1.220g产品,配成100ml甲醇溶液,取25.00ml溶液,用0.1000mol/L KOH标准溶液滴定,重复滴定四次,每次消耗的体积如下表所示。
第一次 | 第二次 | 第三次 | 第四 | |
体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
(5)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果______________(填“偏大”、“偏小”或“不变”)。计算样品中苯甲酸纯度为______________。