题目内容
【题目】工业催化剂 K3[Fe(C2O4)3]·3H2O是翠绿色晶体,在421~553℃时,分解为Fe2O3、K2CO3、CO、CO2、H2O。实验室由草酸亚铁晶体(FeC2O4·H2O)、草酸钾(K2C2O4)、草酸(H2C2O4)和双氧水(H2O2)混合制备。请回答下列问题
(1)写出H2O2的电子式:____________________
(2)配平该方程式____FeC2O4·H2O+___H2O+ __K2 C2O4+__H 2C2O4=__K3[Fe(C2O4)3]·3H2O
(3)制备过程中要防止草酸被H2O2氧化,请写出草酸被H2O2氧化的化学反应方程式______;
(4)配合物的稳定性可以用稳定常数K来衡量,如Cu2++4NH3=[Cu(NH3)4]2+,其稳定常数表达式为:![]() 。已知K[Fe(C2O4)3]3—=1020, K[Fe(SCN)3]=2
。已知K[Fe(C2O4)3]3—=1020, K[Fe(SCN)3]=2![]() 103,能否用KSCN溶液检验K3[Fe(C2O4)3]·3H2O中的铁元素?______(填“是”或“否”)若选“否”,请设计检验铁元素的方案_________________________________________。
103,能否用KSCN溶液检验K3[Fe(C2O4)3]·3H2O中的铁元素?______(填“是”或“否”)若选“否”,请设计检验铁元素的方案_________________________________________。
【答案】![]() 2 1 3 1 2 H2C2O4+H2O2=2CO2↑+2H2O 否 取适量晶体加热,将加热后的固体残留物溶解在稀硫酸中,滴加KSCN溶液.若溶液呈血红色则晶体中含有铁元素,反之则无(其他合理也可)
2 1 3 1 2 H2C2O4+H2O2=2CO2↑+2H2O 否 取适量晶体加热,将加热后的固体残留物溶解在稀硫酸中,滴加KSCN溶液.若溶液呈血红色则晶体中含有铁元素,反之则无(其他合理也可)
【解析】
(1)H2O2为共价化合物,其电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)根据水的个数的最小公倍数为6,则FeC2O42H2O的化学计量数为2,K3[Fe(C2O4)3]3H2O的化学计量数3,然后由原子守恒可知,该化学反应为2FeC2O42H2O+H2O2+3K2C2O4+H2C2O4=2K3[Fe(C2O4)3]3H2O,故答案为:2;1;3;1;2;
(3)草酸被H2O2氧化生成水和二氧化碳,该反应为H2C2O4+H2O2=2CO2↑+2H2O,故答案为:H2C2O4+H2O2=2CO2↑+2H2O;
(4)因Fe3++3C2O42-= [Fe(C2O4)3]3-,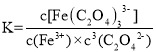 =1020,配合物的稳定性可以用稳定常数K来衡量,K值越大说明生成的配合物越稳定,已知K[Fe(C2O4)3]3—=1020, K[Fe(SCN)3]=2
=1020,配合物的稳定性可以用稳定常数K来衡量,K值越大说明生成的配合物越稳定,已知K[Fe(C2O4)3]3—=1020, K[Fe(SCN)3]=2![]() 103,说明[Fe(C2O4)3]3—远远比Fe(SCN)3稳定,向K3[Fe(C2O4)3]·3H2O溶液中加入KSCN溶液,[Fe(C2O4)3]3—中的Fe3+不能与SCN-反应转化为Fe(SCN)3,也就不能显示血红色。无法验证铁元素;检验铁元素的方案为取适量晶体加热,取固体残留物溶解在H2SO4中,取上层清液于试管中,滴加KSCN溶液.若溶液呈血红色则有铁元素,反之则无;
103,说明[Fe(C2O4)3]3—远远比Fe(SCN)3稳定,向K3[Fe(C2O4)3]·3H2O溶液中加入KSCN溶液,[Fe(C2O4)3]3—中的Fe3+不能与SCN-反应转化为Fe(SCN)3,也就不能显示血红色。无法验证铁元素;检验铁元素的方案为取适量晶体加热,取固体残留物溶解在H2SO4中,取上层清液于试管中,滴加KSCN溶液.若溶液呈血红色则有铁元素,反之则无;
故答案为:否;取适量晶体加热,取固体残留物溶解在H2SO4中,取上层清液于试管中,滴加KSCN溶液.若溶液呈血红色则有铁元素,反之则无;

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
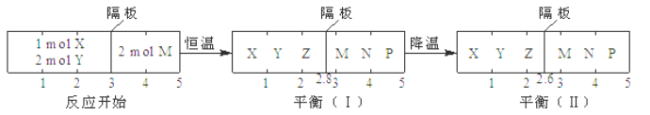
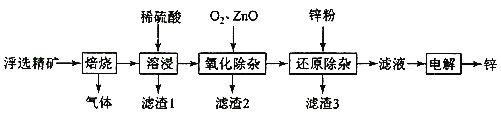
英才计划同步课时高效训练系列答案【题目】我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
请回答下列问题:
(1)焙烧过程中产生的气体化学式__。
(2)溶浸时,提高浸出率的方法有____。(至少写出两种)
(3)利用Fe(OH)3悬浊液与含SO2的烟气反应生成FeSO4,可以使烟气脱硫,该反应的离子方程式为__。产物FeSO4在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为__。
(4)氧化除杂时,加入ZnO调节溶液pH,当用广泛pH试纸测得pH值为___时,可认为已达除杂目的。
A.2 B.2.8 C.4 D.6.2
(5)滤渣3成分为______。
(6)若将闪锌矿直接浸入稀硫酸,要使0.10 molZnS完全溶于1LH2SO4(发生反应ZnS+H2SO4 =ZnSO4+H2S),则需H2SO4的最低浓度为___。(Ksp[ZnS]=2.5×10-22,H2S的K1=1×10-7,K2=1×10-14,忽略反应前后液体体积变化)
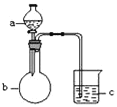
【题目】用如图所示装置进行下列实验,所选的药品、现象和结论正确的一组是( )
选项 | a | b | c | 现象 | 结论 | 装置 |
A | 稀盐酸 | 大理石 | Na2SiO3溶液 | c中有白色胶状沉淀生成 | H2CO3酸性大于H2SiO3 |
|
B | 浓盐酸 | MnO2 | 石蕊试液 | 石蕊试液先变红后褪色 | 氯气具有漂白性 | |
C | 稀硫酸 | 锌粒 | 水 | 一段时间有气泡 | 反应生成了H2 | |
D | NaOH溶液 | Al | 水 | 产生大量气泡 | Al能与NaOH溶液反应 |
A.AB.BC.CD.D
【题目】已知在温度低于570℃ 时,还原铁粉与水蒸气反应的产物是FeO;高于570℃ 时,生成Fe3O4。老师用下图所示实验装置,完成了还原铁粉与水蒸气反应的演示实验。

甲同学为探究实验后试管内固体的成分,进行了下列实验:
实验编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末放入试管中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
② | 向试管中滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |
试回答下列问题:
(1)湿棉花的作用是______________。
(2)写出高于570℃ 时,Fe 与水蒸气反应的化学方程式:___________。
(3)乙同学认为加入KSCN 溶液没有出现血红色的原因可能是固体中没有Fe3O4,也有可能是因为___(填物质名称)过量造成的。该物质过量时,溶液中还会发生反应,导致加入KSCN 溶液时没有出现血红色,该反应的离子方程式是______________。
(4)丙同学利用上述实验①加盐酸后的溶液制取白色的Fe(OH)2沉淀,向滤液中加入足量NaOH 溶液后,观察到的实验现象为___。