��Ŀ����
����Ŀ����Ԫ������A��һ�ֽ�ǿ�Ļ�ԭ���������ô���������Һ�����İ����Ƶã�64gA��ȫȼ�յõ�4.48L�ܶ�Ϊ1.25g��L��1������B(������ܶȾ��ڱ�״���²ⶨ)��
��1��A�Ļ�ѧʽ___________________��
��2��д������������Һ�����İ����Ʊ�A�����ӷ���ʽ_________________________��A���Ʊ������а�����Ҫ������������_____________________________________��
��3��A�����ɫ��CuO��Ӧ��������B��һ��ש��ɫ�����ʣ�д���û�ѧ����ʽ__________��
��4����֪2һ��ϩ����˳���칹(����ͼ��ʾ)������˫��ͬһ��ģ���Ϊ˳ʽ:����˫������ģ���Ϊ��ʽ�����л�����C������Ԫ����A��ͬ��Ħ������С��A��C��ͨ��A������ʵ����Ĺ�������ǡ����ȫ��Ӧ�õ���ʵ�������C���ܴ������ֽṹ����д�����ǵĽṹʽ_____________��_____________��
���𰸡�N2H4 ClO����2NH3�T N2H4��Cl��+H2O ����������ǿ�����ԣ���ֹ�������ƹ�������N2H4���� 4CuO+ N2H4�T 2Cu2O��N2��+ 2H2O ![]()
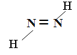
��������
��1����Ԫ������A��һ�ֽ�ǿ�Ļ�ԭ���������ô���������Һ�����İ����Ƶã�6.4gA��ȫȼ�յõ�������ܶ�Ϊ1.25g/L������B����Ħ������=1.25g/L��22.4L/mol=28g/mol��������ΪN2��A�к���NԪ�أ�Ԫ���غ��֪����Ӧ������ˮ��˵��A�л�����HԪ�أ� 4.48L���������ʵ���=![]() =0.2mol��������=0.2mol��28g/mol=5.6g����6.4gA��HԪ������=6.4g-5.6g=0.8g��Hԭ�����ʵ���=
=0.2mol��������=0.2mol��28g/mol=5.6g����6.4gA��HԪ������=6.4g-5.6g=0.8g��Hԭ�����ʵ���=![]() =0.8mol����A��N��Hԭ����Ŀ֮��=0.2mol��2:0.8mol=1:2����AΪN2H4���ʴ�Ϊ��N2H4��
=0.8mol����A��N��Hԭ����Ŀ֮��=0.2mol��2:0.8mol=1:2����AΪN2H4���ʴ�Ϊ��N2H4��
��2���������������������Ӧ����N2H4������������ԭ��Ӧ���ɿ�֪��������NaCl������Ԫ���غ��֪��ˮ���ɣ���Ӧ����ʽΪ��NaClO+2NH3�TN2H4+NaCl+H2O�����ӷ�Ӧ����ʽΪ��ClO����2NH3�T N2H4��Cl��+H2O���������ƾ���ǿ�����ԣ���������N2H4�������İ����ɷ�ֹN2H4���������ʴ�Ϊ��NaClO+2NH3�TN2H4+NaCl+H2O���������ƾ���ǿ�����ԣ���������N2H4�������İ�����ֹN2H4��������
��3��N2H4���ɫ��CuO��Ӧ����ש��ɫ������ͭ��������ˮ����Ӧ����ʽΪ��4CuO+N2H4�T2Cu2O+N2+2H2O���ʴ�Ϊ��4CuO+N2H4�T2Cu2O+N2+2H2O��
��4��������C������Ԫ����A��ͬ��Ħ������С��A��C��ͨ��A������ʵ����Ĺ�������ǡ����ȫ��Ӧ�õ������C�Ļ�ѧʽΪN2H2������2һ��ϩ����˳���칹�Ľ��ͣ����C����ԭ����˫��ͬһ��ģ���Ϊ˳ʽ����ԭ����˫������ģ���Ϊ��ʽ�����ǵĽṹʽ�ֱ�Ϊ![]() ��
��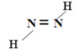 ��
��

����Ŀ����һ������SO2��g����O2��g��ͨ�����Ϊ2L�ĺ����ܱ������У��ڲ�ͬ�¶��½��з�Ӧ���õ��±��е��������ݣ�����˵����ȷ���ǣ�������
ʵ�� ��� | �¶�/�� | ƽ�ⳣ�� /mol��1L | ��ʼ��/mol | ƽ����/mol | ||
SO2 | O2 | SO2 | O2 | |||
1 | T1 | K1 | 4 | 2 | x | 0.8 |
2 | T2 | K2 | 4 | 2 | 0.4 | y |
A. x��2.4��y��0.2 B. T1��T2�Ĵ�С��T1��T2
C. K1��K2�Ĵ�С��K1��K2 D. T1��ʱ������ʼ��������K1��K2