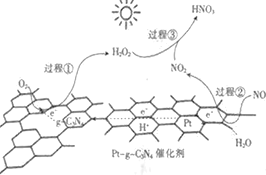
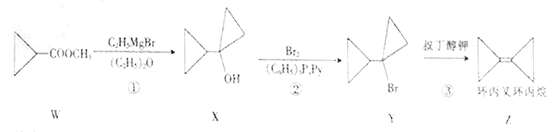
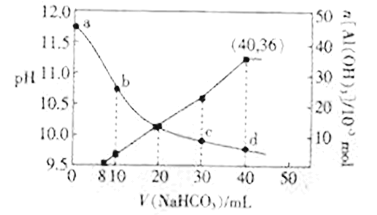
题目内容
【题目】香叶醇是合成玫瑰香油的主要原料,其结构简式如图:下列有关香叶醉的叙述正确的是( )

A. 香叶醇的分子式为C10H18O
B. 不能使溴的四氯化碳溶液褪色
C. 不能使酸性高锰酸钾溶液褪色
D. 能发生加成反应不能发生取代反应
【答案】A
【解析】
由结构简式可知,该有机物的分子式为C10H18O,分子中含2个碳碳双键和1个羟基,能表现烯烃和醇的性质。
A项、由香叶醇的结构简式可知,该有机物的分子式为C10H18O,故A正确;
B项、香叶醇分子中含有碳碳双键,能和溴发生加成反应而使溴的四氯化碳溶液褪色,故B错误;
C项、香叶醇分子中含有含有碳碳双键和与羟基相连的碳原子上连有2个氢原子,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,故C错误;
D项、香叶醇分子中含有碳碳双键和醇羟基,能发生加成反应和氧化反应,故D错误。
故选A。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】工业上利用H2合成氢的反应原理为:3H2(g)+N2(g) ![]() 2NH3(g)。现有甲、乙两个容积为1L的密闭容器.在相同条件下,按不同的反应物投入量进行合成氢反应相关数据如下表示:
2NH3(g)。现有甲、乙两个容积为1L的密闭容器.在相同条件下,按不同的反应物投入量进行合成氢反应相关数据如下表示:
容器 | 甲 | 乙 |
反应物投入量 | 2molH2、2molN2 | 4malH2.4molN2 |
平衡时N2的浓度(mol/L) | c1=1.5 | c2 |
NH3的体积分数 | ω1 | ω2 |
混合气体的密度(g/L) | ρ1 | ρ2 |
(1)下列情况下,反应达到平衡状态的是_____(填序号)
A、3molH-H共价键断裂同时有6molN-H共价键形成
B、3v正(N2)=v逆(H2)
C、混合气体的平均相对分子质量保持不变
(2)反应的平衡常数K=_____________________(结果保留3位有效数字).
(3)分析上表中的数据,有以下关系:c2________3mol/L;ω1________ω2(填“>”、“<”、“=”);
【题目】(一)某实验小组利用如下装置(部分固定装置略)进行氮气与钙的反应,并探究其产物的性质及化学式。请回答下列问题。

(1)反应过程中末端导管必须插入试管C的水中,目的是____。(填字母)
A.吸收反应中剩余的氮气
B.控制通入气体的流速
C.防止空气中的氧气倒流进入反应装置,干扰反应
(2)该小组同学认为根据相应的质量关系可以求出生成物的化学式,数据记录如下:
A的质量m0/g | A与钙的质量m1/g | A与产物的质量m2/g |
14.80 | 15.08 | 15.15 |
①通过计算得到化学式CaxN2,其中x=____。
②小组同学查阅资料得知产物为Ca3N2,能与水强烈反应,请写出Ca3N2与水反应的化学方程式_____。
(二)铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2![]() 6SO2+Fe3O4,若有3molFeS2参加反应,转移电子的物质的量为_____。
6SO2+Fe3O4,若有3molFeS2参加反应,转移电子的物质的量为_____。
(2)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为____。
(3)将一定量的Fe2O3溶于160mL 5molL-1盐酸中,再加入一定量铁粉,铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为____。