题目内容
【题目】(1) 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,c(Ag+)由大到小的顺序为:_________。
(2) 含有Cr2O![]() 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O![]() 。为了使废水的排放达标,进行如下处理:Cr2O
。为了使废水的排放达标,进行如下处理:Cr2O![]()
![]() Cr3+、Fe3+
Cr3+、Fe3+![]() Cr(OH3)、Fe(OH)3
Cr(OH3)、Fe(OH)3
(a) 该废水中加入绿矾和H+,发生反应的离子方程式为__________________。
(b) 若处理后的废水中残留的c(Fe3+)=2.0×10-13 mol·L-1,则残留的Cr3+的浓度为_____
(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
(3)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。请回答下列问题:
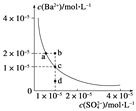
(a) 下列说法正确的是________(填序号)。
A.向BaSO4饱和溶液中加入固体Na2SO4可以由a点变到b点
B.通过蒸发可以由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
(b) 将100 mL 1 mol·L-1 H2SO4溶液加入100 mL含Ba2+ 0.137 g的溶液中充分反应后,过滤,滤液中残留的Ba2+的物质的量浓度约为__________。
【答案】 ④>①>②>③ Cr2O![]() +6Fe2++14H+===2Cr3++6Fe3++7H2O 3.0×10-6 mol·L-1 c 2.02×10-10 mol/L
+6Fe2++14H+===2Cr3++6Fe3++7H2O 3.0×10-6 mol·L-1 c 2.02×10-10 mol/L
【解析】(1)溶度积在一定温度下是一个常数,因此通过Ksp(AgCl)= c(Ag+)×c(Cl-)分别得到:①蒸馏水中含银离子浓度和氯离子浓度相同;②0.1molL-1盐酸溶液中氯离子浓度为0.1mol/L,抑制沉淀溶解平衡;③0.1molL-1MgCl2溶液中Cl-浓度为0.2mol/l,抑制沉淀溶解平衡;④0.1mol/L硝酸银溶液中Ag+浓度为0.1mol/L,抑制沉淀溶解平衡,Cl-浓度越大,Ag+浓度越小,则Ag+离子浓度大小为:④>①>②>③;正确答案:④>①>②>③ 。
(2) (a) 亚铁离子具有还原性,被Cr2O![]() 在酸性环境下氧化为铁离子,离子方程式为:Cr2O
在酸性环境下氧化为铁离子,离子方程式为:Cr2O![]() +6Fe2++14H+===2Cr3++6Fe3++7H2O;正确答案:Cr2O
+6Fe2++14H+===2Cr3++6Fe3++7H2O;正确答案:Cr2O![]() +6Fe2++14H+===2Cr3++6Fe3++7H2O。
+6Fe2++14H+===2Cr3++6Fe3++7H2O。
(b) 若处理后的废水中残留的c(Fe3+)=2.0×10-13 mol·L-1, Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=4.0×10-38,计算得到c3(OH-)=2×10-25 mol·L-1,,则残留的Cr3+的浓度为Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=6.0×10-31, c(Cr3+)= 3.0×10-6 mol·L-1 ;正确答案:3.0×10-6 mol·L-1。
(3) (1)硫酸钡溶液中存在着溶解平衡,a点在平衡曲线上,加入Na2SO4,会增大c(SO42-),平衡左移, c(Ba2+)应降低,A错误;d点时溶液不饱和,蒸发溶剂水, c(SO42-) 、c(Ba2+)均增大,B错误;d点表示QC< Ksp ,溶液不饱和,不会有沉淀析出,C正确;Ksp是一常数,温度不变Ksp不变,在曲线上的任意一点Ksp都相等,D错误;正确答案:C。
(2)由图象可以知道Ksp(BaSO4)=10-5×10-5=10-10 ,将100 mL 1 mol·L-1 H2SO4溶液加入100 mL含Ba2+ 0.137 g的溶液中充分反应后,反应生成BaSO4,硫酸根离子过量,加入n(Ba2+)=0.137/137=0.001mol,剩余的硫酸根离子的浓度为:c(SO42-)=(0.1×1-0.001)/2=0.495mol/L,所以剩余的钡离子为:c(Ba2+)= Ksp(BaSO4)/c(SO42-)=10-10/0.495=2.02×10-10 mol/L;正确答案: 2.02×10-10 mol/L;正确答案:2.02×10-10 mol/L。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】已知:![]() ,利用下图装置用正丁醇合成正丁醛。相关数据如下:
,利用下图装置用正丁醇合成正丁醛。相关数据如下:

物质 | 沸点/℃ | 密度/(g· | 水中溶解性 |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,正确的是 ( )
A. 向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
B. 当温度计1示数为90~95℃,温度计2示数在117.2℃左右时,收集产物
C. 反应结束,将馏出物倒入分液漏斗中以分去水层,粗正丁醛从分液漏斗上口倒出
D. 为加快反应,应将酸化的Na2Cr2O7溶液一次性全部加入正丁醇中


