题目内容
【题目】电解硫酸钠溶液生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为l∶2,下列有关说法正确的是( )

A. a电极反应式为:2H++2e-= H2↑
B. 产物丙为硫酸溶液
C. 离子交换膜d 为阴离子交换膜
D. 每转移0.1mol电子,产生1.12 L的气体乙
【答案】B
【解析】电解硫酸钠溶液时,阳极上生成氧气,电极反应式为2H2O-4e-=O2↑+4H+,阴极反应式为 4H2O+4e-=2H2↑+4OH-,测得同温同压下,气体甲与气体乙的体积比约为1:2,则甲是氧气、乙是氢气,则a是阳极、b是阴极,阳极区域生成硫酸、阴极区域生成NaOH。A.a为阳极,电极反应式为2H2O-4e-=O2↑+4H+,故A错误;B.通过以上分析知,a为阳极,同时生成硫酸,所以产物丙是硫酸,故B正确;C.产物丁是NaOH,则离子交换膜d是阳离子交换膜,故C错误;D.生成乙的电极反应式为4H2O+4e-=2H2↑+4OH-,每转移0.1 mol电子,产生氢气的物质的量为0.05mol,但温度和压强未知,故无法确定气体摩尔体积,则无法计算氢气的体积,故D错误;答案选B

【题目】某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于下表:
温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度(×10﹣3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①可以判断该分解反应已经达到化学平衡的是(填字母).
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0℃时的分解平衡常数为 .
(2)已知:NH2COONH4+2H2ONH4HCO3+NH3H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO﹣)随时间变化趋势如图所示.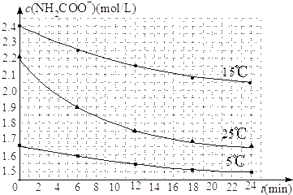
③计算25℃时,0~6min氨基甲酸铵水解反应的平均速率为 .
④根据图中信息,如何说明水解反应的平均速率随温度升高而增大: .
【题目】海洋动物海鞘中含有种类丰富、结构新颖的次生代谢产物,是海洋抗肿瘤活性物质的重要来源之一。一种从海鞘中提取具有抗肿瘤活性的天然产物的流程如下:
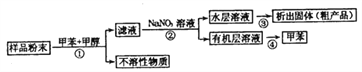
下列关于该流程中各步骤的说法中,错误的是( )
选项 | 步骤 | 采用装置 | 主要仪器 |
A | ① | 过滤装置 | 漏斗 |
B | ② | 分液装置 | 分液漏斗 |
C | ③ | 蒸发装置 | 坩埚 |
D | ④ | 蒸馏装置 | 蒸馏烧瓶 |
A. A B. B C. C D. D