ЬтФПФкШн
ЁОЬтФПЁПЮэіВбЯжиЮЃКІШЫРрНЁПЕКЭЩњЬЌЛЗОГЃЌПЊЗЂЮШЖЈИпаЇЕФЭбСђЭбЯѕЙЄвеММЪѕЪЧЙњФкЭтбаОПЕФШШЕуЁЃбаОПБэУїЃЌЕЊбѕЛЏЮя(NOx)КЭЖўбѕЛЏСђдкаЮГЩЮэіВЪБгыДѓЦјжаЕФАБгаЙиЃЌЦфзЊЛЏЙиЯЕШчЯТЭМЫљЪОЁЃ

(1)NH3ЕФЕчзгЪНЪЧ_________ЁЃ
(2)NH4NO3ШмвКжаЕФРызгХЈЖШгЩДѓЕНаЁЫГађЪЧ_________ЁЃ
(3)ЂйвбжЊЃКSO2ЩњГЩSO3змЗДгІЗНГЬЪНЪЧ
2SO2(g)ЃЋO2(g) ![]() 2SO3(g) ІЄHЃНЃ196.6 kJ/mol
2SO3(g) ІЄHЃНЃ196.6 kJ/mol
ДЫЗДгІПЩЭЈЙ§ШчЯТСНВНЭъГЩЃК
2NO(g)ЃЋO2 (g ) ![]() 2NO2(g) ІЄH1ЃНЃ113 kJ/mol
2NO2(g) ІЄH1ЃНЃ113 kJ/mol
NO2(g)ЃЋSO2(g) ![]() SO3(g)ЃЋNO(g) ІЄH2ЃН_________ЁЃ
SO3(g)ЃЋNO(g) ІЄH2ЃН_________ЁЃ
Ђк вЛЖЈЮТЖШЯТЃЌЯђ2 LКуШнУмБеШнЦїжаГфШыNO2КЭSO2Иї1 molЃЌ5minДяЕНЦНКтЃЌДЫЪБШнЦїжаNO2КЭNOЕФХЈЖШжЎБШЮЊ1ЁУ3ЃЌдђNO2ЕФЦНКтзЊЛЏТЪЪЧ_________ЁЃ
(4)РћгУNaClO2/H2O2ЫсадИДКЯЮќЪеМСПЩЭЌЪБгааЇЭбСђЁЂЭбЯѕЁЃ
Ђй жЦБИЩйСПNaClO2ЃЌЦфзАжУШчЯТЭМЫљЪОЃК

зАжУIПижЦЮТЖШдк35~55ЁцЃЌЭЈШыSO2НЋNaClO3ЛЙдЮЊClO2(ЗаЕуЃК11Ёц)ЃЌЗДгІЕФРызгЗНГЬЪНЪЧ_____________________________________________ЃЌ
зАжУЂђжаЗДгІЩњГЩNaClO2ЃЌДЫЗДгІжазїЮЊбѕЛЏМСЕФЪЧ_______________ЃЌЗДгІКѓШмвКжавѕРызгГ§СЫClO2ЃЁЂClO3ЃЁЂClЃЁЂClOЃЁЂOHЃЭтЛЙПЩФмКЌгаЕФвЛжжвѕРызгЪЧ_______________ЁЃ
Ђк гУжЦЕУЕФNaClO2/H2O2ЫсадИДКЯЮќЪеМСЭЌЪБЖдNOЁЂSO2НјаабѕЛЏЕУЕНЯѕЫсКЭСђЫсЖјГ§ШЅЁЃдкЮТЖШвЛЖЈЪБЃЌn(H2O2)/n(NaClO2)ЁЂШмвКpHЖдЭбСђЭбЯѕЕФгАЯьШчЯТЭМЫљЪОЃК


ДгЩЯЭМжаПЩжЊЭбСђЭбЯѕзюМбЬѕМўЪЧ_________ЁЃЭМ жаSO2ЕФШЅГ§ТЪЫцpHЕФдіДѓЖјдіДѓЃЌЖјNO ЕФШЅГ§ТЪдкpH>5.5ЪБЗДЖјМѕаЁЃЌЧыНтЪЭNOШЅГ§ТЪМѕаЁЕФПЩФмдвђЪЧ______________________________ЁЃ
ЁОД№АИЁП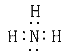 c(NO3-) > c(NH4+) > c(H+) > c(OHЁЊ) ЁЊ41.8 kJ/mol 75% SO2+2ClO3ЁЊ===2ClO2+SO42- ClO2 SO42- pHдк5.5~6.0 n(H2O2)/n(NaClO2) = 6 ЃК1 двђЃКpH>5.5вдКѓЃЌЫцзХpHдіДѓЃЌNOЕФЛЙдадНЕЕЭЃЛЛђH2O2КЭNaClO2бѕЛЏадМѕШѕЃЌВЛФмНЋNOбѕЛЏЮЊЯѕЫс
c(NO3-) > c(NH4+) > c(H+) > c(OHЁЊ) ЁЊ41.8 kJ/mol 75% SO2+2ClO3ЁЊ===2ClO2+SO42- ClO2 SO42- pHдк5.5~6.0 n(H2O2)/n(NaClO2) = 6 ЃК1 двђЃКpH>5.5вдКѓЃЌЫцзХpHдіДѓЃЌNOЕФЛЙдадНЕЕЭЃЛЛђH2O2КЭNaClO2бѕЛЏадМѕШѕЃЌВЛФмНЋNOбѕЛЏЮЊЯѕЫс
ЁОНтЮіЁП
БОЬтЮЊзлКЯЬтЁЃ
ЃЈ1ЃЉЕЊдзггыЧтдзгЪЧЭЈЙ§ЙВгУЕчзгЖдЯрНсКЯаЮГЩАБЦјЃЌЦфжаКЌга3ИіЙВМлМќЃЌЕчзгЪНЮЊ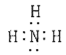 ЃЛ
ЃЛ
ЃЈ2ЃЉДЫаЁЬтПМВщЕФЪЧбЮРрЕФЫЎНтЃЌNH4NO3ШмЮЊЧПЫсШѕМюбЮЃЌдкЫЎжаЗЂЩњЫЎНтЃЌШмвКЯдЫсадЃЌдђЯѕЫсИљРызгЕФХЈЖШДѓгкяЇИљРызгЕФХЈЖШЃЌЧтРызгЕФХЈЖШДѓгкЧтбѕИљРызгЕФХЈЖШЃЛ
ЃЈ3ЃЉЂйДЫаЁЬтПМВщЕФЪЧИЧЫЙЖЈТЩЕФдЫгУЃЌ2ИіNO2(g)ЃЋSO2(g) ![]() SO3(g)ЃЋNO(g) ЕШгкзмЗДгІ2SO2(g)ЃЋO2(g)
SO3(g)ЃЋNO(g) ЕШгкзмЗДгІ2SO2(g)ЃЋO2(g) ![]() 2SO3(g) МѕШЅЦфжаЕФвЛИіЗДгІ2NO(g)ЃЋO2 (g )
2SO3(g) МѕШЅЦфжаЕФвЛИіЗДгІ2NO(g)ЃЋO2 (g ) ![]() 2NO2(g)ЃЛ
2NO2(g)ЃЛ
ЂкБОаЁЬтПМВщЕФЪЧШ§ЖЮЪННтЬтЕФдЫгУЃЛ
ЃЈ4ЃЉЂйДЫаЁЬтПМВщЕФЪЧбѕЛЏЛЙдЗДгІЗНГЬЪНЕФЪщаДЃЌЯШИљОнМлЬЌЩ§НЕевГібѕЛЏМСЁЂЛЙдМСЁЂбѕЛЏВњЮяЁЂЛЙдВњЮяЃЌдйИљОнЕУЪЇЕчзгЪиКуХфЦНРызгЗНГЬЪНSO2+2ClO3ЁЊ===2ClO2+SO42-ЃЛДЫЭтЛЙПМВщСЫбѕЛЏМСЕФХаЖЯЃЌбѕЛЏМСЪЧдЊЫиЛЏКЯМлНЕЕЭЕУЕчзгЗЂЩњЛЙдЗДгІЕФЮяжЪЃЛ
ЂкИљОнзѓЭМNO2ЕФЭбГ§ТЪдкn(H2O2)/n(NaClO2) = 6 ЃК1ЪБаЇЙћзюКУЃЌДѓгк6:1вдКѓБфЛЏВЛДѓЃЌИљОнгвЭМNO2ЕФЭбГ§ТЪдкpHЮЊ5.5~6.0ЪБаЇЙћзюКУЃЌДѓгк6.0вдКѓЗДЖјМѕаЁЃЌдђСђЭбЯѕзюМбЬѕМўЪЧpHдк5.5~6.0 n(H2O2)/n(NaClO2) = 6 ЃК1ЃЛSO2ЕФШЅГ§ТЪЫцpHЕФдіДѓЖјдіДѓЃЌЖјNO ЕФШЅГ§ТЪдкpH>5.5ЪБЗДЖјМѕаЁЪЧвђЮЊpH>5.5вдКѓЃЌЫцзХpHдіДѓЃЌNOЕФЛЙдадНЕЕЭЃЛЛђH2O2КЭNaClO2бѕЛЏадМѕШѕЃЌВЛФмНЋNOбѕЛЏЮЊЯѕЫсЁЃ
ЃЈ1ЃЉЕЊдзгзюЭтВуга5ИіЕчзгЃЌДяЕН8ЕчзгЮШЖЈНсЙЙашЕУ3ИіЕчзгЃЌЧтдзгзюЭтВу1ИіЕчзгЃЌДяЕН2ЕчзгЮШЖЈНсЙЙашЕУвЛИіЕчзгЃЌдђЕЊдзгКЭ3ИіЧтдзгПЩаЮГЩ3ЖдЙВгУЕчзгЖдЃЌЕчзгЪНЮЊ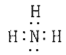 ЁЃБОаЁЬтД№АИЮЊЃК
ЁЃБОаЁЬтД№АИЮЊЃК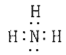 ЁЃ
ЁЃ
ЃЈ2ЃЉNH4NO3ШмЮЊЧПЫсШѕМюбЮЃЌдкЫЎжаЗЂЩњЫЎНтЃЌШмвКЯдЫсадЃЌдђРызгХЈЖШгЩДѓЕНаЁЫГађЪЧc(NO3-) > c(NH4+) > c(H+) > c(OHЁЊ)ЁЃБОаЁЬтД№АИЮЊЃКc(NO3-) > c(NH4+) > c(H+) > c(OHЁЊ)ЁЃ
ЃЈ3ЃЉЂйИљОнИЧЫЙЖЈТЩ2ИіNO2(g)ЃЋSO2(g) ![]() SO3(g)ЃЋNO(g) ЕШгкзмЗДгІ2SO2(g)ЃЋO2(g)
SO3(g)ЃЋNO(g) ЕШгкзмЗДгІ2SO2(g)ЃЋO2(g) ![]() 2SO3(g) МѕШЅЦфжаЕФвЛИіЗДгІ2NO(g)ЃЋO2 (g )
2SO3(g) МѕШЅЦфжаЕФвЛИіЗДгІ2NO(g)ЃЋO2 (g ) ![]() 2NO2(g) ЃЌдђ2(-ІЄH2)ЃНІЄH-ІЄH1ЃНЃ196.6 kJ/mol-ЃЈЃ113 kJ/molЃЉ=-83.6 kJ/molЃЌдђІЄH2ЃН-41.8 kJ/molЁЃБОаЁЬтД№АИЮЊЃК-41.8 kJ/molЁЃ
2NO2(g) ЃЌдђ2(-ІЄH2)ЃНІЄH-ІЄH1ЃНЃ196.6 kJ/mol-ЃЈЃ113 kJ/molЃЉ=-83.6 kJ/molЃЌдђІЄH2ЃН-41.8 kJ/molЁЃБОаЁЬтД№АИЮЊЃК-41.8 kJ/molЁЃ
Ђк
NO2(g)ЃЋSO2(g) ![]() SO3(g)ЃЋNO(g)
SO3(g)ЃЋNO(g)
Ц№ЪМХЈЖШЃЈmol/LЃЉ 0.5 0.5 0 0
БфЛЏХЈЖШЃЈmol/LЃЉ x x x x
ЦНКтХЈЖШЃЈmol/LЃЉ 0.5-x 0.5-x x x
ИљОнЬтвтЃЈ0.5-xЃЉ/x=1:3 x=0.375 NO2ЕФЦНКтзЊЛЏТЪЮЊ(0.375/0.5)ЁС100%=75%ЁЃБОаЁЬтД№АИЮЊЃК75%ЁЃ
ЃЈ4ЃЉЂйзАжУIПижЦЮТЖШдк35~55ЁцЃЌЭЈШыSO2НЋNaClO3ЛЙдЮЊClO2(ЗаЕуЃК11Ёц)ЃЌSO2жаЕФСђдЊЫиЕФЛЏКЯМлгЩ+4МлЩ§ИпЕН+6МлБЛбѕЛЏЮЊSO42-ЃЌ NaClO3жаТШдЊЫиЕФЛЏКЯМлгЩ+5МлНЕЕЭЕН+4МлБЛЛЙдЮЊClO2ЃЌРызгЗНГЬЪНЮЊSO2+2ClO3ЁЊ===2ClO2+SO42-ЃЛзАжУIжаВњЩњЕФClO2ОЕМЙмНјШызАжУЂђЩњГЩNaClO2ЃЌClO2жаТШдЊЫиЕФЛЏКЯМлгЩ+4МлНЕЕЭЕН+3МлЃЌЗЂЩњЛЙдЗДгІЃЌClO2ЮЊбѕЛЏМСЃЛзАжУIжаЭЈШыSO2ЕФВЛЭъШЋЗДгІЃЌдкзАжУЂђжаБЛбѕЛЏЩњГЩСђЫсЃЌШмвКжаПЩФмДцдкSO42-ЃЛБОаЁЬтД№АИЮЊЃКO2+2ClO3ЁЊЃН2ClO2+SO42-ЃЛ ClO2ЃЛSO42-ЁЃ
ЂкИљОнзѓЭМNO2ЕФЭбГ§ТЪдкn(H2O2)/n(NaClO2) = 6 ЃК1ЪБаЇЙћзюКУЃЌДѓгк6:1вдКѓБфЛЏВЛДѓЃЌИљОнгвЭМNO2ЕФЭбГ§ТЪдкpHЮЊ5.5~6.0ЪБаЇЙћзюКУЃЌДѓгк6.0вдКѓЗДЖјМѕаЁЃЌдђСђЭбЯѕзюМбЬѕМўЪЧ pHдк5.5~6.0 n(H2O2)/n(NaClO2) = 6 ЃК1ЃЛSO2ЕФШЅГ§ТЪЫцpHЕФдіДѓЖјдіДѓЃЌЖјNO ЕФШЅГ§ТЪдкpH>5.5ЪБЗДЖјМѕаЁЪЧвђЮЊpH>5.5вдКѓЃЌЫцзХpHдіДѓЃЌNOЕФЛЙдадНЕЕЭЃЛЛђH2O2КЭNaClO2бѕЛЏадМѕШѕЃЌВЛФмНЋNOбѕЛЏЮЊЯѕЫсЁЃБОаЁЬтД№АИЮЊЃКpHдк5.5~6.0 n(H2O2)/n(NaClO2) = 6 ЃК1ЃЛpH>5.5вдКѓЃЌЫцзХpHдіДѓЃЌNOЕФЛЙдадНЕЕЭЃЛЛђH2O2КЭNaClO2бѕЛЏадМѕШѕЃЌВЛФмНЋNOбѕЛЏЮЊЯѕЫсЁЃ

ЁОЬтФПЁПЯТСаЪЕбщжаЕФбеЩЋБфЛЏЃЌгыбѕЛЏЛЙдЗДгІЮоЙиЕФЪЧ
A | B | C | D | |
ЪЕбщ | аТжЦТШЫЎЕЮШыNa2S ШмвКжа | ввДМЕЮШыK2Cr2O7ЫсадШмвКжа | БЅКЭFeCl3ШмвКЕЮШыЗаЫЎжа | ВнЫсЕЮШыKMnO4 ЫсадШмвКжа |
ЯжЯѓ | ВњЩњЛЦЩЋЛызЧ | ШмвКгЩГШЩЋБфЮЊТЬЩЋ | вКЬхБфЮЊКьКжЩЋЧвГЮЧхЭИУї | ВњЩњЮоЩЋЦјЬхЃЌШмвКзЯКьЩЋЭЪШЅ |
A. AB. BC. CD. D
ЁОЬтФПЁПЪЕбщаЁзщЬНОПТСЦЌзіЕчМЋВФСЯЪБЕФдЕчГиЗДгІЃЌЪЕбщШчЯТЃК
Ђй | Ђк | Ђл |
|
|
жѓЗаРфШДКѓЕФШмвК |
ЕчСїМЦжИеыЯђгвЦЋзЊЃЌУОЦЌЁЂТСЦЌБэУцВњЩњЮоЩЋЦјХн | ЕчСїМЦжИеыбИЫйЯђгвЦЋзЊЃЌж№НЅЯђСуПЬЖШЛжИДЃЌОСуПЬЖШКѓМЬајЯђзѓЦЋзЊЃЛУОЦЌБэУцПЊЪМЪБЮоУїЯдЯжЯѓЃЌвЛЖЮЪБМфКѓгаЩйСПЦјХнвнГіЃЛТСЦЌБэУцГжајгаЦјХнвнГіЁЃ | ЕчСїМЦжИеыЯђзѓЦЋзЊЁЃТСЦЌБэУцгаЦјХнвнГіЃЌЭЦЌУЛгаУїЯдЯжЯѓЃЛдМ3ЗжжгКѓЃЌЭЦЌБэУцгаЩйСПЦјХнВњЩњЃЌТСЦЌБэУцЦјХнТдгаМѕЩйЁЃ |
ЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
A. ЪЕбщЂйжаЃЌУОЦЌзідЕчГиЕФИКМЋ
B. ЪЕбщЂкжаЃЌГѕЪМЪБЕФЪЕбщЯжЯѓЖдгІЕФдЕчГиЗДгІЮЊЃК2Mg + O2 + 2H2O ![]() 2Mg( OH) 2
2Mg( OH) 2
C. ЪЕбщЂкжаЃЌвЛЖЮЪБМфКѓЃЌТСЦЌЗЂЩњЕФЕчМЋЗДгІЪНЮЊЃКAl - 3 e - ![]() Al 3+
Al 3+
D. ЪЕбщЂй ~ ЂлПЩЭЦжЊЃЌТСЦЌзіЕчМЋВФСЯЪБЕФдЕчГиЗДгІгыСэвЛИіЕчМЋЕФЕчМЋВФСЯЁЂШмвКЕФЫсМюадЁЂШмвКжаШмНтЕФO2ЕШвђЫигаЙи
ЁОЬтФПЁПФГЭЌбЇдкЪЕбщЪвНјааЬњбЮгыбЧЬњбЮЯрЛЅзЊЛЏЪЕбщЁЃ
ЪЕбщЂёЃКНЋFe3+зЊЛЏЮЊFe2+

(1)Fe3+гыCuЗлЗЂЩњЗДгІЕФРызгЗНГЬЪНЮЊ_________________________________ЁЃ
(2)ФГбЇЩњгУЖдБШЪЕбщЗЈЬНОПАзЩЋГСЕэВњЩњЕФдвђЃЌЧыЬюаДЪЕбщЭђАИЃК
ЪЕбщЗНАИ | ЯжЯѓ | НсТл |
ВНжш1ЃКШЁ4mLЂй__________ mol/LCuSO4ШмвК,ЯђЦфжаЕЮМг3ЕЮ0.1mol/LKSCNШмвК | ВњЩњАзЩЋГСЕэ | CuSO4ШмвКгыKSCNШмвКЗДгІВњЩњСЫАзЩЋГСЕэ |
ВНжш2ЃКШЁ4mLЂк__________mol/LFeSO4 ШмвКЯђЦфжаЕЮМг3ЕЮ0.1mol/LKSCNШмвК | ЮоУїЯдЯжЯѓ |
ВщдФзЪСЯЃК
вбжЊЂйSCN-ЕФЛЏбЇаджЪгыI-ЯрЫЦ Ђк2Cu2++4I-=2CuIЁ§+I2
Cu2+гыSCN-ЗДгІЕФРызгЗНГЬЪНЮЊЂл___________________________________ЁЃ
ЪЕбщЂђЃКНЋFe2+зЊЛЏЮЊFe3+
ЪЕбщЗНАИ | ЯжЯѓ |
Яђ3mL0.1mol/LFeSO4ШмвКжаМгШы 3mL0.5mol/LЯЁЯѕЫс | ШмвКБфЮЊзиЩЋЃЌЗХжУвЛЖЮЪБМфКѓЃЌзиЩЋЯћЪЇЃЌШмвКБфЮЊЛЦЩЋ |
ЬНОПЩЯЪіЯжЯѓГіЯжЕФдвђЃК
ВщдФзЪСЯЃКFe2++NO![]() Fe(NO)2+(зиЩЋ)
Fe(NO)2+(зиЩЋ)
(3)гУРызгЗНГЬЪННтЪЭNOВњЩњЕФдвђ___________________________________ЁЃ
(4)ДгЛЏбЇЗДгІЫйТЪгыЯоЖШЕФНЧЖШЖдЬхЯЕжаДцдкЕФЗДгІНјааЗжЮіЃК
ЗДгІЂёЃКFe2+гыHNO3ЗДгІЃЛЗДгІЂђЃКFe2+гыNOЗДгІ
ЂйЗДгІЂёЪЧвЛИіВЛПЩФцЗДгІЃЌЩшМЦЪЕбщЗНАИМгвджЄУї_____________________________ЁЃ
ЂкЧыгУЛЏбЇЦНКтвЦЖЏдРэНтЪЭШмвКгЩзиЩЋБфЮЊЛЦЩЋЕФдвђ_____________________________ЁЃ









