��Ŀ����
����Ŀ����10mLijŨ�ȵ�NaOH��Һ��ͨ��CO2��������ҺM����CO2ͨ�����IJ�ͬ����ҺM�����Ҳ��ͬ������M����μ���0.1mol/L���ᣬ����������V��CO2���������������V��HCl���Ĺ�ϵ��ͼʾ��������������з����жϲ���ȷ���ǣ�������CO2���ܽ⣩�� ��
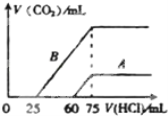
A. ����A����M�е�����ΪNaOH��Na2CO3
B. ����B����M��NaHCO3��Na2CO3�����ʵ���֮��Ϊ1��2
C. ԭNaOH��Һ�����ʵ���Ũ��Ϊ0.75mol/L
D. ��A��B��֪������ʵ��ͨ���CO2�������3��10
���𰸡�B
��������A�����A��ʼû���������������һ�����������������壬��������ķ�ӦΪ��HCO3-+H+=H2O+CO2������A��ֻ��Na2CO3����ʼʱֻ����CO32-+H+=HCO3-����ǰ�����������ĵ��������Ӧ��ȣ���ʵ�ʿ�ʼ����������������ڲ���������̼�����ĵ������������A���߱���M�е�����ΪNaOH��Na2CO3����A��ȷ��B�B�����У���������ǰ�������������������Ϊ��25��(75-25)=1��2����M��NaHCO3��Na2CO3�����ʵ���֮��Ϊ1��1����B����C�����75mL����ʱ������̼������ﵽ���ʱ��ҺΪNaCl��Һ��������ԭ���غ����ԭ���غ㣬��n(NaOH)=n(HCl)=0.075L��0.1molL-1=0.0075mol����c(NaOH)= 0.0075mol��0.01L=0.75molL-1����C��ȷ��D�����A���ɶ�����̼�����������Ϊ��(75-60)mL=15mL������B���ɶ�����̼�����������Ϊ��(75-25)mL=50mL���ɷ�ӦHCO3-+H+=H2O+CO2����֪��CO2�����֮��Ϊ15mL��50mL=3��10������ԭ��Һ������ʵ��ͨ���CO2�������Ϊ3��10����D��ȷ��