题目内容
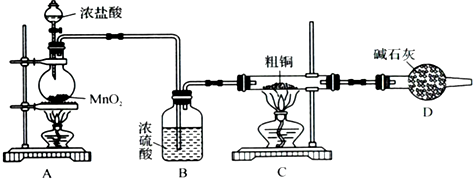
某研究小组用如下图装置进行铜与浓硫酸反应的实验研究。

(1)写出铜与浓硫酸反应的化学方程式 ;
(2)B试管口堵的棉花喷有的试剂是 ;
(3)充分反应后,研究小组同学发现铜和硫酸都有剩余。在不补充浓硫酸的前提下,加入下列物质不能使剩余铜片溶解的是 (填写序号);
①KNO3 ②FeCl3 ③Fe2O3 ④HCl
(4)研究小组同学向反应后的溶液中加入足量的氧化铜,使剩余的硫酸全部转化为硫酸铜,过滤后,将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4?xH2O)。研究小组同学采用加热法测定该晶体里结晶水x的值。
①在他们的实验操作中,至少称量 次;
②下面是其中一次实验的数据:
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 19.7g |
根据上表数据计算x的实测值为 ,这次实验中产生误差的原因可能是
(填序号)。
A.硫酸铜晶体中含有不挥发性杂质 B.实验前晶体表面有湿存水
C.加热时有晶体飞溅出去 D.加热失水后露置在空气中冷却
(5)研究小组同学发现,反应后的A试管中还得到一种黑色的固体,经鉴定它是两种元素形成的盐,元素间的质量比为2:1,其化学式为 。
(1)Cu+2H2SO4(浓) ![]() CuSO4 +SO2↑+2H2O
CuSO4 +SO2↑+2H2O
(2)NaOH溶液
(3)④
(4)①4
②3.3 A和D
(5)CuS

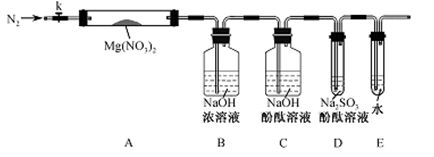
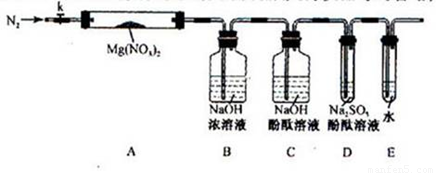


 (2)上述反应结束后,仍需通一段时间的空气,其目的是_______________________________
(2)上述反应结束后,仍需通一段时间的空气,其目的是_______________________________