题目内容
牙釉质的主要成分羟基磷灰石[Ca10(PO4)6(OH)2]在水中能极少溶解Ca10(PO4)6(OH)2(s)?10Ca2+(aq)+6PO43-(aq)+2OH-(aq),已知25℃时Ksp[Ca10(PO4)6(OH)2]=2.35×10-59,Ksp[Ca10(PO4)6F2]=7.1×10-61,Ksp[CaCO3]=5×10-9,Ksp[CaF2]=4×10-11,下列说法不正确是( )A.口腔内残留食物会发酵使口腔呈酸性,所以饭后、睡前应该要漱口
B.饮用水中氟元素含量较低的地区使用含氟牙膏可有效防止龋齿
C.25℃时饱和CaCO3溶液和饱和CaF2溶液相比,后者c(Ca2+)较大
D.25℃时,在CaCO3悬浊液中加入NaF溶液后,CaCO3不可能转化为CaF2
【答案】分析:难溶电解质的Ksp越小,可说明电解质越难溶,发生反应时,Ksp较大的电解质可转化为Ksp较小的电解质,从溶解平衡的角度解答该题.
解答:解:A.口腔内残留食物会发酵使口腔呈酸性,牙釉质的主要成分羟基磷灰石溶解Ca10(PO4)6(OH)2(s)?10Ca2+(aq)+6PO43-(aq)+2OH-(aq),可导致氢离子与氢氧根离子反应而平衡向溶解方法移动而导致牙齿受损,故A正确;
B.使用含氟牙膏可使[Ca10(PO4)6(OH)2]转化为更难溶的[Ca10(PO4)6F2],可有效防止龋齿,故B正确;
C.25℃时饱和CaCO3溶液和饱和CaF2溶液相比,CaCO3溶液c(Ca2+)= mol/L,CaF2溶液c(Ca2+)=
mol/L,CaF2溶液c(Ca2+)=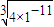 mol/L,则CaF2溶液中c(Ca2+)较大,故C正确;
mol/L,则CaF2溶液中c(Ca2+)较大,故C正确;
D.在CaCO3悬浊液中加入NaF溶液后,当c(Ca2+)×c2(F-)>Ksp[CaF2]时,可生成CaF2,故D错误.
故选D.
点评:本题考查难溶电解质的溶解平衡及转化等问题,注意根据溶度积进行计算和判断,题目难度中等.
解答:解:A.口腔内残留食物会发酵使口腔呈酸性,牙釉质的主要成分羟基磷灰石溶解Ca10(PO4)6(OH)2(s)?10Ca2+(aq)+6PO43-(aq)+2OH-(aq),可导致氢离子与氢氧根离子反应而平衡向溶解方法移动而导致牙齿受损,故A正确;
B.使用含氟牙膏可使[Ca10(PO4)6(OH)2]转化为更难溶的[Ca10(PO4)6F2],可有效防止龋齿,故B正确;
C.25℃时饱和CaCO3溶液和饱和CaF2溶液相比,CaCO3溶液c(Ca2+)=
 mol/L,CaF2溶液c(Ca2+)=
mol/L,CaF2溶液c(Ca2+)=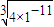 mol/L,则CaF2溶液中c(Ca2+)较大,故C正确;
mol/L,则CaF2溶液中c(Ca2+)较大,故C正确;D.在CaCO3悬浊液中加入NaF溶液后,当c(Ca2+)×c2(F-)>Ksp[CaF2]时,可生成CaF2,故D错误.
故选D.
点评:本题考查难溶电解质的溶解平衡及转化等问题,注意根据溶度积进行计算和判断,题目难度中等.

练习册系列答案
相关题目
牙釉质的主要成分羟基磷灰石[Ca10(PO4)6(OH)2]在水中能极少溶解Ca10(PO4)6(OH)2(s)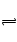 10Ca2+(aq)+6PO43-(aq)+2OH-(aq),已知25℃时Ksp[Ca10(PO4)6(OH)2]="2.35" ×10-59, Ksp[Ca10(PO4)6F2]=7.1× 10-61,Ksp[CaCO3]="5" ×10-9,Ksp[CaF2]=4×10-11,下列说法不正确是( )
10Ca2+(aq)+6PO43-(aq)+2OH-(aq),已知25℃时Ksp[Ca10(PO4)6(OH)2]="2.35" ×10-59, Ksp[Ca10(PO4)6F2]=7.1× 10-61,Ksp[CaCO3]="5" ×10-9,Ksp[CaF2]=4×10-11,下列说法不正确是( )
| A.口腔内残留食物会发酵使口腔呈酸性,所以饭后、睡前应该要漱口 |
| B.饮用水中氟元素含量较低的地区使用含氟牙膏可有效防止龋齿 |
| C.25℃时饱和CaCO3溶液和饱和CaF2溶液相比,后者c(Ca2+)较大 |
| D.25℃时,在CaCO3悬浊液中加入NaF溶液后,CaCO3不可能转化为CaF2 |
 10Ca2+(aq)+6PO43-(aq)+2OH-(aq),已知25℃时Ksp[Ca10(PO4)6(OH)2]=2.35
10Ca2+(aq)+6PO43-(aq)+2OH-(aq),已知25℃时Ksp[Ca10(PO4)6(OH)2]=2.35 10-59, Ksp[Ca10(PO4)6F2]=7.1
10-59, Ksp[Ca10(PO4)6F2]=7.1