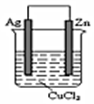
题目内容
16.下列溶液中的c(Cl-)与100mL1mol/L的AlCl3溶液c(Cl-)相等的是( )| A. | 200mL1mol/L的NaCl溶液 | B. | 150mL3mol/L的KCl溶液 | ||
| C. | 150mL2mol/LNH4Cl溶液 | D. | 100mL1.5mol/L的MgCl2溶液 |
分析 100mL1mol/L的AlCl3溶液c(Cl-)为1mol/L×3=3mol/L,结合溶质的浓度、物质的构成计算.
解答 解:A.1mol/L的NaCl溶液中c(Cl-)为1mol/L,故A不选;
B.3mol/L的KCl溶液中c(Cl-)为3mol/L,故B选;
C.2mol/LNH4Cl溶液中c(Cl-)为2mol/L,故C不选;
D.1.5mol/L的MgCl2溶液c(Cl-)为1.5mol/L×2=3mol/L,故D选;
故选BD.
点评 本题考查物质的量浓度的计算,为高频考点,把握物质的构成、溶质与离子浓度的关系为解答的关键,侧重分析与计算能力的考查,注意离子浓度与溶液体积无关,题目难度不大.

练习册系列答案
相关题目
6.已知一个12C原子的质量是mg,元素R的某种原子的一个原子的质量为ng,元素R的这种原子的相对原子质量为( )
| A. | n | B. | $\frac{n}{m}$ | C. | $\frac{12n}{m}$ | D. | $\frac{n}{{N}_{A}}$ |
7.下列叙述正确的是( )
| A. | 胶体区别于其他分散系的根本原因是胶体有丁达尔现象 | |
| B. | 分散系中分散质粒子直径由小到大的正确顺序是:溶液<浊液<胶体 | |
| C. | 有单质参加或有单质生成的反应一定是氧化还原反应 | |
| D. | 失电子的反应物在反应中作还原化剂,反应中被氧化 |
4.用下列实验装置进行相应的实验,设计正确且能达到实验目的是( )
| A. |  用图所示装置验证反应产物二氧化碳 | |
| B. |  装置可用于证明SO2与NaOH溶液发生了反应 | |
| C. |  若装置中X为CCl4,可用于吸收氨气或氯化氢 | |
| D. |  装置 可用于实验室从食盐水中提取氯化钠 |
1.下列离子方程式中,不正确的是( )
| A. | 用NaOH溶液除去铝箔表面的氧化膜,Al2O3+2OH-═2AlO2-+H2O | |
| B. | 向AlCl3溶液中加入过量氨水,Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 用胃舒平(复方氢氧化铝)缓解胃酸(HCl)过多,OH-+H+═H2O | |
| D. | 向污水中投放明矾,生成能凝聚悬浮物的胶体,Al3++3H2O?Al(OH)3 (胶体)+3H+ |
8.1mol某烃在氧气中充分燃烧,需要消耗氧气179.2L(标准状况).它在光照条件下与氯气反应能生成三种不同的一氯取代物,该烃的结构简式是( )
| A. |  | B. | CH3-CH2-CH2-CH2-CH3 | ||
| C. | 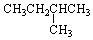 | D. |  |
6.下列离子方程式正确的是( )
| A. | Na2S2O3溶液中加入稀硫酸:2S2O32-+2H+═SO42-+3S↓+H2O | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -═2 Al(OH)3↓+3BaSO4↓ | |
| C. | 盐碱地(含较多NaCl、Na2CO3)中加入石膏,降低土壤的碱性,涉及的方程式为:Ca2++CO32-═CaCO3↓ | |
| D. | 向NH4HCO3溶液中加过量NaOH溶液并加热:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+NH3↑+2H2O |
 反应类型加聚反应
反应类型加聚反应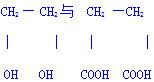 的聚合反应n HOCH2CH2OH+n HOOCCH2CH2COOH
的聚合反应n HOCH2CH2OH+n HOOCCH2CH2COOH 
 +(2n-1)H2O反应类型缩聚反应
+(2n-1)H2O反应类型缩聚反应 反应类型取代反应
反应类型取代反应