��Ŀ����
����Ŀ��һ�������£������Ϊ10 L���ܱ������У�1 mol X��1 mol Y�������·�Ӧ��2X(g) �� Y(g) ![]() Z(g)����60 s�ﵽƽ�⣬����0.3 mol Z������˵����ȷ����( )
Z(g)����60 s�ﵽƽ�⣬����0.3 mol Z������˵����ȷ����( )
A���ﵽƽ��ʱXŨ��Ϊ0.04 mol/L
B�������������Ϊ20 L��Z��ƽ��Ũ�ȱ�Ϊ0.015mol/L
C��������ѹǿ��ƽ�����������ƶ���ƽ�ⳣ�����
D���������¶ȣ�X���������������÷�Ӧ��H��0
���𰸡�A
��������
���������A����60s�ﵽƽ�⣬����0.3mol Z�������ĵ�XΪ0.6mol�����Դﵽƽ��ʱXŨ��Ϊ![]() =0.04 mol/L����A��ȷ��B���ݻ�����Ϊ20L��ѹǿ��СΪԭ����һ�룬���ƽ�ⲻ�ƶ���ZŨ�ȱ�Ϊԭ����
=0.04 mol/L����A��ȷ��B���ݻ�����Ϊ20L��ѹǿ��СΪԭ����һ�룬���ƽ�ⲻ�ƶ���ZŨ�ȱ�Ϊԭ����![]() ������ѹǿ��Сʱ��ƽ�������ƶ���ZŨ��С��ԭ����
������ѹǿ��Сʱ��ƽ�������ƶ���ZŨ��С��ԭ����![]() ����Z��ƽ��Ũ��С��0.015mol/L����B����C��ƽ�ⳣ��ֻ���¶ȵı仯���仯������������ѹǿ����ƽ�ⳣ�����䣬��C����D���������¶ȣ�X�������������˵�����淴Ӧ�����ƶ������淴Ӧ���ȣ�������Ӧ����Ϊ���ȣ�����H��0����D����ѡA��
����Z��ƽ��Ũ��С��0.015mol/L����B����C��ƽ�ⳣ��ֻ���¶ȵı仯���仯������������ѹǿ����ƽ�ⳣ�����䣬��C����D���������¶ȣ�X�������������˵�����淴Ӧ�����ƶ������淴Ӧ���ȣ�������Ӧ����Ϊ���ȣ�����H��0����D����ѡA��

 ���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д�
���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д� ���Ͱ�ͨ������ϵ�д�
���Ͱ�ͨ������ϵ�д� �ٷ�ѧ����ҵ��������ϵ�д�
�ٷ�ѧ����ҵ��������ϵ�д�����Ŀ��ij��ȤС��ͬѧ���о�SO2��������ʡ�
(1)�Ƚ��±��е��������ʹ�ϵ����2��������X�Ļ�ѧʽ�� ��
��1�� | ��2�� |
C��CO��CO2��H2CO3��Na2CO3����NaHCO3�� | S ��SO2��SO3��X��Na2SO4��NaHSO4 |
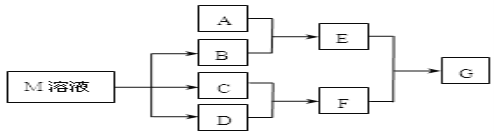
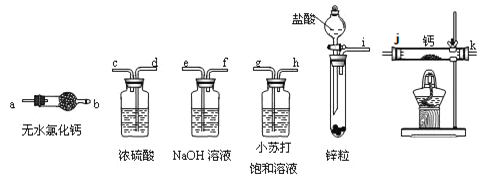
(2)������ͼװ��������SO2������
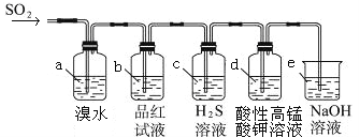
��װ��a�е������ǣ� �� (������������������)˵��SO2��Ư����
����װ��e����40 mL 2��5 molL��1 NaOH��Һ����Ӧ������4��8 g����װ��IV�з�����Ӧ���ܻ�ѧ����ʽ�� ��
(3)��С��ļס�����λͬѧ������ͼװ�ü���̽��SO2������Ư���ԣ�

ͨ��һ��ʱ���ͬѧʵ�������Ʒ����Һ��������ɫ������ͬѧ��ʵ��������Ʒ����Һ��ʱ������Ʊ��Խ��Խdz���Ը��ݸ�ʵ��װ�ú�����ͬѧ��ʵ�����ش����⡣
���Է�����ͬѧʵ������У������ӷ���ʽ��ʾƷ����Һ����ɫ��ԭ���ǣ� ��
������Ϊ��ͬѧ������������Ʒ����Һ���Խ��Խdz�ģ�