题目内容
【题目】LiFePO4可作为新型锂离子也池的正极材料。以钛铁矿(主要成分为FeTiO3、Fe2O3及少量CuO、SiO2杂质)为主要原料生产TiOSO4,同时得到的绿矾(FeSO4·7H2O)与磷酸和LiOH反应可制各 LiFePO4, LiFePO4的制备流程如下图所示:

请回答下列问题:
(1)酸溶时 FeTiO3与硫酸反应的化学方程式可表示为____________________。
(2)①加铁屑还原的目的是__________,②过滤前需要检验还原是否完全,其实验操作可描述为_________。
(3)①“反应”需要按照一定的顺序加入FeSO4溶液、磷酸和LiOH,其加入顺序应为____________________,②其理由是______________________________。
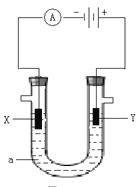
(4)滤渣中的铜提纯后可用于制取Cu2O,Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,电解总反应:2Cu+H2O![]() Cu2O+H2↑。则该装置中铜电极应连接直流电源的__________极,石墨电极的电极反应式为____________________,当有0. 1mol Cu2O生成时电路中转移__________mol电子。
Cu2O+H2↑。则该装置中铜电极应连接直流电源的__________极,石墨电极的电极反应式为____________________,当有0. 1mol Cu2O生成时电路中转移__________mol电子。

【答案】FeTiO3+2H2SO4=FeSO4+TiOSO4+2H2O 把铁离子还原为亚铁离子,置换出铜 取少量反应液于试管中,加入几滴硫氰化钾溶液,如果溶液变红色,说明还原没有完全,如果溶液不变红色,说明还原已经完全 磷酸 硫酸亚铁溶液 LiOH 先加磷酸,在酸性环境可以抑制亚铁离子的水解、氧化,又避免生成氢氧化铁沉淀 正 2H2O+2e-=H2↑+2OH- 0.2
【解析】
(1)酸溶时 FeTiO3与硫酸反应生成FeSO4和TiOSO4,据此写出方程式;
(2)①铁具有还原性,能够把铁离子还原为亚铁离子,能够把铜离子还原为铜;
②还原的是否完全,通过检验反应后的溶液中是否含有铁离子即可,选用试剂硫氰化钾溶液;
(3)亚铁离子能够发生水解,易被氧气氧化,需要加酸抑制其水解,据此分析三种试剂加入的顺序;
(4)电解池的阳极与电源的正极相连,发生氧化反应,电解池的阴极与电源的负极相连,发生还原反应;根据总反应方程式及电子转移数目进行计算;
(1)酸溶时 FeTiO3与硫酸反应生成FeSO4和TiOSO4,化学方程式为:FeTiO3+2H2SO4=FeSO4+TiOSO4+2H2O;
综上所述,本题答案是:FeTiO3+2H2SO4=FeSO4+TiOSO4+2H2O。
(2)①铁具有还原性,能够与铁离子、铜离子反应;因此加铁屑的目的是把铁离子还原为亚铁离子,并置换出铜;
综上所述,本题答案是:把铁离子还原为亚铁离子,置换出铜。
②加入的还原剂铁能够把铁离子还原为亚铁离子,能够把铜离子还原为铜,还原的是否完全,可以通过检验还原后的溶液中是否存在铁离子,其操作方法为:取少量反应液于试管中,加入几滴硫氰化钾溶液,如果溶液变红色,说明还原没有完全,如果溶液不变红色,说明还原已经完全;
综上所述,本题答案是:取少量反应液于试管中,加入几滴硫氰化钾溶液,如果溶液变红色,说明还原没有完全,如果溶液不变红色,说明还原已经完全。
(3)①“反应”需要按照磷酸、FeSO4溶液和LiOH顺序加入试剂;
综上所述,本题答案是:磷酸、 硫酸亚铁溶液、LiOH。
②亚铁离子能够发生水解,易被氧气氧化,因此先加磷酸,产生酸性环境,然后再加入FeSO4溶液,在酸性环境下可以抑制亚铁离子的水解、氧化,又避免生成氢氧化铁沉淀;最后加入LiOH;
综上所述,本题答案是:在酸性环境可以抑制亚铁离子的水解、氧化,又避免生成氢氧化铁沉淀;
(4) 根据电解总反应:2Cu+H2O![]() Cu2O+H2↑可知,Cu发生氧化反应,做阳极,应与电源的正极相连;石墨电极的为电解池的阴极,发生还原反应,电极反应式为2H2O+2e-=H2↑+2OH-;根据该反应可知2e-~Cu2O,所以当有0.1mol Cu2O生成时电路中转移0.2mol电子。
Cu2O+H2↑可知,Cu发生氧化反应,做阳极,应与电源的正极相连;石墨电极的为电解池的阴极,发生还原反应,电极反应式为2H2O+2e-=H2↑+2OH-;根据该反应可知2e-~Cu2O,所以当有0.1mol Cu2O生成时电路中转移0.2mol电子。
综上所述,本题答案是:正,2H2O+2e-=H2↑+2OH-, 0.2。

 出彩同步大试卷系列答案
出彩同步大试卷系列答案