题目内容
【题目】下列有关热化学方程式及其叙述正确的是
A.氢气的燃烧热为285.5 kJ·mol-1,则水分解的热化学方程式为:2H2O(l)===2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1
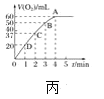
B.已知2C(石墨,s)+O2(g)===2CO(g)ΔH=-221 kJ·mol-1,则石墨的燃烧热为110.5 kJ·mol-1
C.已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应后,最多可放出92.4 kJ的热量
2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应后,最多可放出92.4 kJ的热量
D.已知C(石墨,s)==C(金刚石,s)ΔH>0,则石墨比金刚石稳定
【答案】D
【解析】
A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,热化学方程式方向改变,焓变符号随之变化;
B.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
C.反应是可逆反应不能进行彻底;
D.物质具有的能量越低越稳定,吸热反应,产物的能量高于反应物的能量;
A.氢气的燃烧热为285.5 kJmol-1,燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,则水分解的热化学方程式为:H2O(l)=H2(g)+0.5O2(g)△H=+285.5 kJmol-1,A项错误;
B.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,已知2C(石墨,s)+O2(g)=2CO(g);△H=-221 kJmol-1,是的氧化物不稳定,则石墨的燃烧热大于110.5 kJmol-1,B项错误;
C.已知N2(g)+3H2(g)![]() 2 NH3(g);△H=-92.4 kJmol-1,反应是可逆反应,则在一定条件下将1molN2和3molH2置于一密闭容器中充分反应后,放出热量小于92.4kJ,C项错误;
2 NH3(g);△H=-92.4 kJmol-1,反应是可逆反应,则在一定条件下将1molN2和3molH2置于一密闭容器中充分反应后,放出热量小于92.4kJ,C项错误;
D. C(石墨s)=C(金刚石s)△H>0,可知石墨转化为金刚石吸热,即金刚石的总能量高,能量越高越不稳定,则石墨比金刚石稳定,D项正确;
答案选D。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】下列有关水溶液中的平衡相关的问题,请填空
(1)已知常温下,将氯化铝溶液和碳酸钠溶液混合,有白色沉淀产生,写出反应离子方程式________。
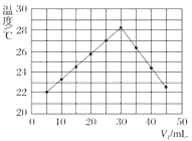
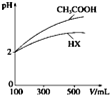
(2)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。同浓度,同体积的CH3COONa与NaX溶液,离子总数目: CH3COONa溶液_______NaX溶液(填>,<,=)
(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
①25℃时,浓度均为0.01 mol·L-1 HCN和NaCN混合溶液显_____性(填酸,碱,中)。溶液中HCN浓度_________CN-浓度(填>,<,=)。
②25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中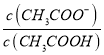 =____________。
=____________。
(4)在25°C下,将x mol·L-1的氨水与y mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+)____c(Cl-)(填“>” 、“<” 或“=” );用含x和y的代数式表示出氨水的电离平衡常数______。