��Ŀ����
����Ŀ������(H2C2O4)��Һ������KMnO4��Һ��Ӧʱ����Һ��ɫ����������죬ijѧϰС��̽����Ӧ������ʹ��ɫ�ӿ����Ҫԭ��������:
���������ϡ�KMnO4��Һ����H2C2O4�ķ�Ӧ����Ϊ��
![]()
��������衿����1:�÷�ӦΪ���ȷ�Ӧ
����2:��Ӧ���ɵ�Mn2���Ը÷�Ӧ�д�����
����3:K���Ը÷�Ӧ�д�����
��С��ͬѧδ���Ũ��ʹ��Ӧ���ʼӿ�ļ��裬ԭ���� ��
����ơ����ʵ�顿��1����ȡ g���ᾧ��(H2C2O4��2H2O)������500 mL 0.10 mol/L H2C2O4��Һ��
�������������б����õ���2�ֶ���������������ƽ�� ��
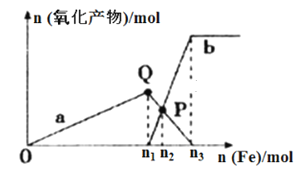
�����в�����ʹ������ҺŨ��ƫ�͵��� (������ѡ�����ĸ���)��
A����ȡ���ᾧ��ʱ�������ᾧ�����������ƽ���� |
B������ʱ���ӿ̶��� |
C�����ձ�����Һת�Ƶ�����ƿ֮ǰ������ƿ������������ˮ |
D��ҡ�Ⱥ�����ҺҺ����ڿ̶��ߣ������ý�ͷ�ιܼ�ˮ�ٶ��� |
��2�����̽������¼����
ʵ�� | �ձ��������Լ�������(mL) | �������� | ��Һ��ɫʱ��(s) | |||
0.10 mol/L | ��Ũ�� | H2O | 0.50 mol/L | |||
1 | 30 | 20 | 30 | 20 | 18 | |
2 | 30 | 20 | 30 | 20 | ˮԡ�����¶�65 �� | 15 |
3 | 30 | 20 | 30 | 20 | ��������MnSO4���� | 3.6 |
4 | 30 | 20 | x | 20 | ����5 mL 0.10 mol/LK2SO4��Һ | 18 |
��x = ������2����
��3������KMnO4������ˮ���л�������أ�Ϊ���ƺ��ȶ���KMnO4��Һ����Ũ����궨��ȡ10.00 mL 0.10 mol/L H2C2O4��Һ����ƿ�У�����10 mL 0.50 mol/Lϡ���ᣬ�ã�2����KMnO4��Һ�ζ�����ƿ��ǡ�ó�dz��ɫ���Ұ���Ӳ���ɫ����¼���ݣ�ƽ������ʵ�飬ƽ������KMnO4��Һ40.00 mL���������Һ������KMnO4��Һ��Ӧ�����ӷ���ʽΪ�� ������ʵ����KMnO4��Һ�����ʵ���Ũ��Ϊ ��
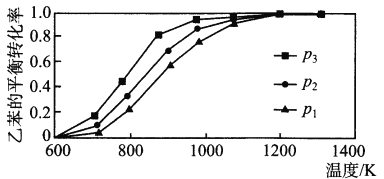
���𰸡���������衿�淴Ӧ��Ũ�Ƚ��ͣ���Ӧ���ʼ���
����ơ����ʵ�顿��1��6.3 g ��500 mL����ƿ ��A��D ��2��25 mL
��3��5H2C2O4��2MnO4�� ��6H��=10CO2��2Mn2����8H2O 0.010 mol/L
�������������������������衿 ��Ϊ�淴Ӧ��Ũ�Ƚ��ͣ���Ӧ���ʼ�������ʵ���з�Ӧ�����Ǽӿ�ġ�
����ơ����ʵ�顿��1�����ᾧ�������="0.5��0.1��126=6.3" g �� ����ΪҪ����500������Һ������ѡ��500 mL����ƿ�� ��A����ΪҪ����6.3�˲��ᾧ�壬���������̣���ʵ�ʳ���������ƫ�ͣ�Ũ��ƫ�ͣ�B����������Һ�����С��Ũ��ƫ��C������ƿ����ˮ����Ӱ��Ũ�ȣ�D��ҡ�Ⱥ�Ӧ�ü�ˮ������ˮ����Ũ��ƫС������ѡA��D�� ��2����Ϊʵ����Ҫ������Һ��Ũ����ͬ�����Ի����Һ�������Ӧ��ȣ�������Ҫ����ˮ�����Ϊ25 mL����3�����ᱻ������������ɶ�����̼�����ӷ���ʽΪ��5H2C2O4��2MnO4�� ��6H��=10CO2��2Mn2����8H2O��������ص�Ũ��="5:(0.1��10)=2:(" 40��x) ��x="0.010" mol/L

����Ŀ��I���Т�BaCl2���ڽ��ʯ����KOH����Na2SO4���ݸɱ�����Ƭ�������ʣ�������Ҫ��ش�
(1)�ۻ�ʱ����Ҫ�ƻ���ѧ������________(��д���ʵ���ţ���ͬ)���ۻ�ʱ��Ҫ�ƻ����ۼ�����________��
(2)�������ӻ��������______________��ֻ�����Ӽ���������________��
(3)�ٵĵ���ʽ��______________���ݵĵ���ʽ��_____________��
II��������(���ӻ�����)������18�����ӣ�
���� | A�� | B2�� | C | D | E | F |
����ص� | �������� | �����˫�˷��� | ���ʣ� ˫�˷��� | ��������˷��� | ����� �ĺ˷��� | |
��ش��������⣺
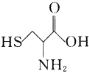
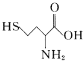
(1)A��Ԫ�ط�����____________��B2���Ľṹʾ��ͼ��________��
(2)C�ĽṹʽΪ__________����֪D�ĵ�����ˮ��Ӧ������������һ���ᣬд���÷�Ӧ�Ļ�ѧ����ʽ��________________________________________
(3)E�ĵ���ʽ��____________________��F��ˮ��Һ��������������F�Ļ�ѧʽ��___________��