��Ŀ����
����Ŀ���о�����ȿ���CO��CO2��Ӧ�öԹ�����̬������������Ҫ�����塣�ش��������⣺
I.CO�����ڸ�¯��������֪
Fe3O4(s)+4CO(g)====3Fe(s)+4CO2(g) ��H1 =a kJ/ mol
3Fe2O3(s)+CO(g)====2Fe3O4 (s)+CO2(g) ��H2=bkJ/mol
��ӦFe2O3(s)+3CO(g)====2Fe(s)+3CO2(g)����H3=_________kJ/mol(�ú�a��b�Ĵ���ʽ��ʾ)
��.һ�������£�CO2��CO���Ի���ת����
��1��ij�¶��£����ݻ�Ϊ2L���ܱ��������ס������ַ�ʽͶ�뷴Ӧ�����Ӧ��CO2(g)+H2(g) ![]() CO(g)+H2O(g)��
CO(g)+H2O(g)��
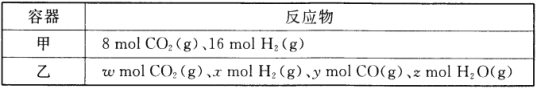
������15min��ﵽƽ�⣬��ʱCO2��ת����Ϊ75%����0~15min��ƽ����Ӧ����v(H2)= _________���������¸÷�Ӧ��ƽ�ⳣ��K=_________��
��ʹƽ������������ͬ�����������������ȣ����ء�x��y��z������Ĺ�ϵ��_________����_________ (�ú�y�ĵ�ʽ��ʾ)��
��2���о��������¶ȡ�ѹǿ�Է�Ӧ��C6H5CH2CH3(g)+CO2(g) ![]() C6H5CH=CH2(g)+CO(g)+H2O(g) ��H�����ұ���ƽ��ת����Ӱ������ͼ��ʾ��
C6H5CH=CH2(g)+CO(g)+H2O(g) ��H�����ұ���ƽ��ת����Ӱ������ͼ��ʾ��
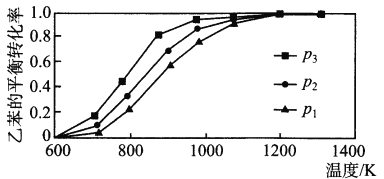
����H_________ 0(����>����<������=��)��ѹǿp1��p 2��p3�Ӵ�С��˳����_________��
��3��CO�ɱ�NO2������CO+NO2![]() CO2+NO�����¶ȸ���225��ʱ����Ӧ����v��=k����c(CO)��c(NO2)��v��=k����c(CO2)��c(NO)��k����k���ֱ�Ϊ�����淴Ӧ���ʳ������������¶ȷ�Χ�ڣ�k����k����÷�Ӧ��ƽ�ⳣ��K֮��Ĺ�ϵΪ_________��
CO2+NO�����¶ȸ���225��ʱ����Ӧ����v��=k����c(CO)��c(NO2)��v��=k����c(CO2)��c(NO)��k����k���ֱ�Ϊ�����淴Ӧ���ʳ������������¶ȷ�Χ�ڣ�k����k����÷�Ӧ��ƽ�ⳣ��K֮��Ĺ�ϵΪ_________��
���𰸡���b+2a��/3 0.2mol��L��1��min��1 1.8 x=2w+y z=y > p1>p2>p3 k=k��/k��
��������
��.���ݸ�˹���ɡ�H3=����H1+2��H2��/3��
��1��v(H2)=��c/��t����K=c(CO)��c(H2O)/c(CO2)��n(H2)����ƽ�ⳣ����
��ʹƽ������������ͬ�����������������ȣ���ء�x��y��z������Ĺ�ϵ(w-y):(x-y)=8:16��x=2w+y��z=y��
��2��ѹǿԽ��,�ұ���ƽ��ת����ԽС��
��3����ƽ��ʱv��=v������k����c(CO)��c(NO2)=k����c(CO2)��c(NO)���ɴ˼��㡣
��.���ݸ�˹���ɡ�H3=����H1+2��H2��/3=��b+2a��/3kJ/mol��
��1��v(H2)=8molx75%/(2L��15min)=0.2mol/(L��min)��
��Ӧ8mol��75%=6 mol CO2,��ƽ��ʱn(CO)=n(H2O)=6mol��n(CO2)=8 mol-6 mol=2 mol, n(H2)=16 mol-6 mol=10 mol��K=c(CO)��c(H2O)/c(CO2)��n(H2)=6molx6mol/(2mol��10mol)=l.8.
Ҫʹƽ������������ͬ������������������,������(w-y):(x-y)=8:16��x=2w+y��z=y��
��2���¶�Խ�ߡ��ұ���ƽ��ת����Խ��,������H>0���÷�Ӧ�ġ�n��>0����ѹǿԽ��,�ұ���ƽ��ת����ԽС,��p1>p2>p3��
��3����ƽ��ʱv��=v������k����c(CO)��c(NO2)=k����c(CO2)��c(NO)����k��/k��=c(CO2)��c(NO)/c(CO)��c(NO2)=k

����Ŀ������(H2C2O4)��Һ������KMnO4��Һ��Ӧʱ����Һ��ɫ����������죬ijѧϰС��̽����Ӧ������ʹ��ɫ�ӿ����Ҫԭ��������:
���������ϡ�KMnO4��Һ����H2C2O4�ķ�Ӧ����Ϊ��
![]()
��������衿����1:�÷�ӦΪ���ȷ�Ӧ
����2:��Ӧ���ɵ�Mn2���Ը÷�Ӧ�д�����
����3:K���Ը÷�Ӧ�д�����
��С��ͬѧδ���Ũ��ʹ��Ӧ���ʼӿ�ļ��裬ԭ���� ��
����ơ����ʵ�顿��1����ȡ g���ᾧ��(H2C2O4��2H2O)������500 mL 0.10 mol/L H2C2O4��Һ��
�������������б����õ���2�ֶ���������������ƽ�� ��
�����в�����ʹ������ҺŨ��ƫ�͵��� (������ѡ�����ĸ���)��
A����ȡ���ᾧ��ʱ�������ᾧ�����������ƽ���� |
B������ʱ���ӿ̶��� |
C�����ձ�����Һת�Ƶ�����ƿ֮ǰ������ƿ������������ˮ |
D��ҡ�Ⱥ�����ҺҺ����ڿ̶��ߣ������ý�ͷ�ιܼ�ˮ�ٶ��� |
��2�����̽������¼����
ʵ�� | �ձ��������Լ�������(mL) | �������� | ��Һ��ɫʱ��(s) | |||
0.10 mol/L | ��Ũ�� | H2O | 0.50 mol/L | |||
1 | 30 | 20 | 30 | 20 | 18 | |
2 | 30 | 20 | 30 | 20 | ˮԡ�����¶�65 �� | 15 |
3 | 30 | 20 | 30 | 20 | ��������MnSO4���� | 3.6 |
4 | 30 | 20 | x | 20 | ����5 mL 0.10 mol/LK2SO4��Һ | 18 |
��x = ������2����
��3������KMnO4������ˮ���л�������أ�Ϊ���ƺ��ȶ���KMnO4��Һ����Ũ����궨��ȡ10.00 mL 0.10 mol/L H2C2O4��Һ����ƿ�У�����10 mL 0.50 mol/Lϡ���ᣬ�ã�2����KMnO4��Һ�ζ�����ƿ��ǡ�ó�dz��ɫ���Ұ���Ӳ���ɫ����¼���ݣ�ƽ������ʵ�飬ƽ������KMnO4��Һ40.00 mL���������Һ������KMnO4��Һ��Ӧ�����ӷ���ʽΪ�� ������ʵ����KMnO4��Һ�����ʵ���Ũ��Ϊ ��
����Ŀ�������£���100 mL 0.1 mol/L NH4Cl��Һ�м����������ʡ��йؽ�����ȷ����
��������� | ���� | |
A | 100 mL0.1 mol/L���� | ��Һ��2c(NH4+)�� c(Cl��) |
B | 0.01 mol Na2O2���� | ��Ӧ��ȫ����ҺpH����c(Na+)�� 2c(Cl��) |
C | 100 mL H2O | ��ˮ�������c(H+)��c(OH��)���(����������) |
D | 100 mL 0.1 mol/L��ˮ | ��Һ�� |
A. A B. B C. C D. D