��Ŀ����
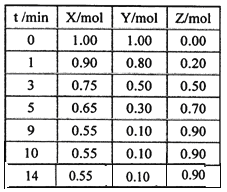
����Ŀ��ijС�����о�ǰ18��Ԫ��ʱ���֣����ݲ�ͬ�ı����ɣ�Ԫ�����ڱ��в�ͬ��������ʽ����������ǰ�ԭ������������˳�����У����γ�ͼ����ʾ������ţ����״��ͼ��ÿ������������һ��Ԫ�أ�����P�������Ԫ�ء�
��1��XԪ���ڳ������ڱ��е�λ�� �������ں��壩��
��2��д��M��Z����Ԫ���γɵĻ�����ĵ���ʽ ��
��3������˵����ȷ����_______
a��ZԪ�ض�Ӧ���⻯���KԪ�ض�Ӧ���⻯��е��
b������������Ԫ�ش���ͬһ����
c��K��L��X����Ԫ�ص����Ӱ뾶��С˳����X3+��L +��K 2
d����K��L����Ԫ����ɵĻ������п��ܺ��й��ۼ�
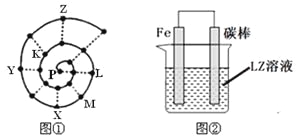
��4��ͼ��װ�ÿ���ģ������ĸ�ʴ������һ���ĵ缫��Ӧʽ�� ������ͼ����Һ�еμ�������̪��Һ�����е�⣬����Fe�缫������Һ��죬д���õ��ص����ӷ���ʽ _�������������������������õ��� _ԭ������������������ԭ���������
���𰸡���1����������IIIA��(1�֣�
��2��![]() ��3��d
��3��d
��4��Fe-2e-=Fe2+(2�֣���2Cl-+2H2O![]() H2��+Cl2��+2OH-(2�֣���ԭ���
H2��+Cl2��+2OH-(2�֣���ԭ���
�����������������P�������Ԫ�أ�����ԭ��������С���������������죬�������ӵ�ԭ�Ӵ���ͬ�壬��ͼ��֪��LΪNa��MΪMg��XΪAl��YΪP��KΪO��ZΪCl��
��1��XԪ����AlԪ�أ�Al��ԭ��������13��λ��Ԫ�����ڱ��ĵ������ڵ���A�壻
��2��M��MgԪ�ء�Z��ClԪ�أ�����ͨ����ʧ�����������ӻ������Ȼ�þ�������ʽΪ![]() ��
��
��3��a��ˮ���Ӽ������������ˮ�ķе�����Ȼ��⣬Aa��b������������Ԫ�ش���ͬһ�壬��������ԽԶ����ԭ�Ӱ뾶Խ��b��ȷ��c�����Ӳ���Խ�������Ӱ뾶Խ���Ӳ�ṹ��ͬ�����ӣ����Ӱ뾶����ԭ�������������С���������Ӱ뾶��С����˳��ΪX3+��L+��K2����c����d����K��L����Ԫ����ɵĻ����������Na2O��Na2O2�����������д������Ӽ����ۼ���d��ȷ����ѡbd��
��4��L��Na��Z��ClԪ�أ�LZ��Һ��NaCl��Һ�����������£�������������ʴ��Fe��������C����������������ʧȥ�õ��ӷ���������Ӧ���缫��ӦʽΪFe-2e-= Fe2+������ͼ����Һ�еμ�������̪��Һ�����е�⣬����Fe�缫������Һ��죬��Fe��������C�������������������ӷŵ����������������������ӷŵ����������������ܷ�ӦʽΪ2Cl-+ 2H2O![]() H2��+ Cl2��+ 2OH-�������������������������õ�ԭ����ԭ���ԭ����
H2��+ Cl2��+ 2OH-�������������������������õ�ԭ����ԭ���ԭ����