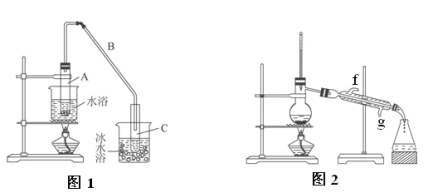
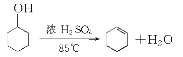
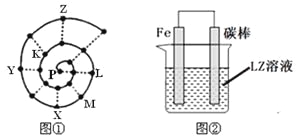
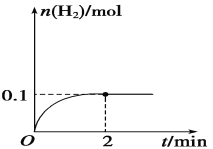
��Ŀ����
����Ŀ��������VSEPRģ���жϣ�������������ԭ�Ӷ���ͬһƽ���ϵ�һ���� ��
A��SO32����NO2�� B��NO3����SO3
C��H3O+��ClO3�� D��PO43����SO32��
��CaF2�ľ�����ͼ��ʾ��
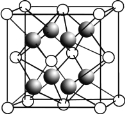
�������й�CaF2�ı�����ȷ����______________��
a��Ca2+��F��������ھ�����������
b��F�������Ӱ뾶С��Cl������CaF2���۵����CaCl2
c�����������ӱ�Ϊ2:1�����ӻ��������CaF2���幹����ͬ
d��CaF2�еĻ�ѧ��Ϊ���Ӽ������CaF2������״̬���ܵ���
��CaF2������ˮ���������ں�Al3+����Һ����ԭ����________________________ (�����ӷ���ʽ��ʾ����֪[AlF6]3������Һ�п��ȶ�����)��
��������F������λ����_________����һ��Ca2+�Ⱦ����������Ca2+��_______����
��ͭ��п����Ԫ�صĵ�һ�����ܡ��ڶ������������ʾ
������/kJ��mol��1 | I1 | I2 |
ͭ | 746 | 1958 |
п | 906 | 1733 |
��д��Cuԭ�Ӻ�������Ų�ʽ ��
��ͭ�ĵ�һ������(I1)С��п�ĵ�һ�����ܣ���ͭ�ĵڶ�������(I2)ȴ����п�ĵڶ������ܣ�����Ҫԭ���� ��
���𰸡�
��B
�Ƣ�bd����3CaF2+ Al3+=[AlF6]3��+3Ca2+����4 ��12
����[Ar]3d104s1
��Cuԭ��ʧȥһ�����Ӻ�������Ų�Ϊ[Ar]3d10����пΪ[Ar]3d104s1�����ݺ��ع���ͭ�ﵽ�˽��ȶ�״̬������Cu�ĵڶ���������Խϴ�
��������
����������� A��SO32-����ԭ�ӵļ۲���Ӷ���=3+![]() (6+2-2��3)=4���йµ��Ӷԣ��ռ乹��Ϊ�����Σ�NO2-����ԭ�ӵļ۲���Ӷ���=2+
(6+2-2��3)=4���йµ��Ӷԣ��ռ乹��Ϊ�����Σ�NO2-����ԭ�ӵļ۲���Ӷ���=2+![]() (5+1-2��2)=3������һ���µ��Ӷԣ��ռ乹��ΪV�Σ���A��ѡ��B��NO3-����ԭ�ӵļ۲���Ӷ���=3+
(5+1-2��2)=3������һ���µ��Ӷԣ��ռ乹��ΪV�Σ���A��ѡ��B��NO3-����ԭ�ӵļ۲���Ӷ���=3+![]() (5+1-3��2)=3��û�йµ��Ӷԣ��ռ乹��Ϊƽ�������Σ�SO3����ԭ�ӵļ۲���Ӷ���=3+
(5+1-3��2)=3��û�йµ��Ӷԣ��ռ乹��Ϊƽ�������Σ�SO3����ԭ�ӵļ۲���Ӷ���=3+![]() (6-2��3)=3��û�йµ��Ӷԣ��ռ乹��Ϊƽ�������Σ���Bѡ��C��H3O+����ԭ�ӵļ۲���Ӷ���=3+
(6-2��3)=3��û�йµ��Ӷԣ��ռ乹��Ϊƽ�������Σ���Bѡ��C��H3O+����ԭ�ӵļ۲���Ӷ���=3+![]() (6-1-3��1)=4������һ���µ��Ӷԣ��ռ乹��Ϊ�����Σ�ClO3-����ԭ�ӵļ۲���Ӷ���=3+
(6-1-3��1)=4������һ���µ��Ӷԣ��ռ乹��Ϊ�����Σ�ClO3-����ԭ�ӵļ۲���Ӷ���=3+![]() (7+1-3��2)=4������һ���µ��Ӷԣ��ռ乹��Ϊ�����Σ���C��ѡ��D��PO43-����ԭ�ӵļ۲���Ӷ���=4+
(7+1-3��2)=4������һ���µ��Ӷԣ��ռ乹��Ϊ�����Σ���C��ѡ��D��PO43-����ԭ�ӵļ۲���Ӷ���=4+![]() (5+3-4��2)=4��û�йµ��Ӷԣ��ռ乹��Ϊ�������壬SO32-����ԭ�ӵļ۲���Ӷ���=3+
(5+3-4��2)=4��û�йµ��Ӷԣ��ռ乹��Ϊ�������壬SO32-����ԭ�ӵļ۲���Ӷ���=3+![]() (6+2-2��3)=4���йµ��Ӷԣ��ռ乹��Ϊ����������D��ѡ����ѡB��
(6+2-2��3)=4���йµ��Ӷԣ��ռ乹��Ϊ����������D��ѡ����ѡB��
����a���������Ӽ���ھ��������;��������Ca2+��F-����ھ����������ã������ھ����������a����b�����Ӿ�����۵�������������ɡ����Ӱ뾶�йأ����Ӱ뾶ԽС�����Ӿ�����۵�Խ�ߣ�����CaF2���۵����CaCl2����b��ȷ��c������Ľṹ���ɱȡ��뾶���йأ��������ӱ�Ϊ2��1�����ʣ���CaF2����ĵ�ɱ���ͬ�����뾶�����ϴ����幹�Ͳ���ͬ����c����d��CaF2�еĻ�ѧ��Ϊ���Ӽ������ӻ�����������ʱ�ܷ������룬���������ƶ������ӣ��ܵ��磬���CaF2������״̬���ܵ��磬��b��ȷ���ʴ�Ϊ��bd����CaF2������ˮ���������ں�Al3+����Һ�У���Ϊ����Һ��F-��Al3+���γɺ��ѵ����������AlF63-��ʹCaF2���ܽ�ƽ�����ƣ��䷴Ӧ�����ӷ���ʽΪ��3CaF2+Al3+=3Ca2++AlF63-���ʴ�Ϊ��3CaF2+Al3+=3Ca2++AlF63-��
�����ݽṹ��֪�������а�����ĿΪ8��![]() +6��
+6��![]() =4��������ĿΪ8����˺���ΪF-��������ÿ��F����Χ��4��Ca2+���ӣ���λ����4��ͼ��CaF2������ÿ����������Ca2+��������ҵȾ����Ca2+������Ϊ3����ͨ��ÿ��Ca2+���γ�8��������ÿ��Ca2+����2�Σ�������Ca2+��������ҵȾ����Ca2+������Ϊ(8��3)��2=12�����ʴ�Ϊ��4��12��
=4��������ĿΪ8����˺���ΪF-��������ÿ��F����Χ��4��Ca2+���ӣ���λ����4��ͼ��CaF2������ÿ����������Ca2+��������ҵȾ����Ca2+������Ϊ3����ͨ��ÿ��Ca2+���γ�8��������ÿ��Ca2+����2�Σ�������Ca2+��������ҵȾ����Ca2+������Ϊ(8��3)��2=12�����ʴ�Ϊ��4��12��
����CuΪ29��Ԫ�أ�ԭ�Ӻ�������Ų�ʽΪ[Ar]3d104s1���ʴ�Ϊ��[Ar]3d104s1��
������е��Ӵ���ȫ����ȫ�ա�����ʱ���ȶ���������̬Cuʧȥһ�����ӱ�ɽṹΪ[Ar]3d10��Cu+�������ϵͣ�����Cu�ĵڶ���������Խϴ�(����̬Znʧȥһ�����ӱ�ɽṹΪ[Ar]3d104s1��Zn+������ʧȥһ�����ӣ�����Zn�ĵڶ���������Խ�С)���ʴ�Ϊ��Cuԭ��ʧȥһ�����Ӻ�������Ų�Ϊ[Ar]3d10����пΪ[Ar]3d104s1�����ݺ��ع���ͭ�ﵽ�˽��ȶ�״̬������Cu�ĵڶ���������Խϴ�