题目内容
18.A、B、C三个烧杯中分别盛有200mL相同物质的量浓度的稀硫酸
(1)分别写出三个装置中铁片表面发生反应的离子方程式:AFe+2H+=Fe2++H2↑;BFe-2e-═Fe2+;C2H++2e-═H2↑.
(2)一段时间后,B中Sn极附近溶液的pH增大(填“增大”、“减小”、“不变”).
(3)一段时间后,C中产生了3.36L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度=0.75mol•L-1.此时,三个烧杯中液体质量由大到小的顺序为:C>A=B(填写序号).
(4)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是BAC(填写序号).
分析 (1)A中铁与稀硫酸反应生成硫酸亚铁和氢气;B中构成原电池铁活泼,作负极发生氧化反应;C中构成原电池锌活泼,铁作正极,发生还原反应;
(2)Fe比Sn活泼,Fe为负极,Sn为正极,负极发生氧化反应,正极发生还原反应;
(3)根据氢气的体积计算硫酸的物质的量,根据溶液的体积计算物质的量浓度;根据溶液质量的变化等于进入和出去的物质的质量之差来判断;
(4)电化学腐蚀的速率大于化学腐蚀的速率,金属做原电池正极时得到保护.
解答 解:(1)A中铁与稀硫酸反应生成硫酸亚铁和氢气,离子方程式为:Fe+2H+=Fe2++H2↑;B中构成原电池铁活泼,作负极发生氧化反应,电极反应式为:Fe-2e-═Fe2+;C中构成原电池锌活泼,铁作正极,氢离子在正极发生还原反应,电极反应式为:2H++2e-═H2↑,
故答案为:Fe+2H+=Fe2++H2↑;Fe-2e-═Fe2+;2H++2e-═H2↑;
(2)铁比锡活泼,锡为原电池正极,电极反应式为:2H++2e-=H2↑;氢离子浓度减小,溶液的pH值增大,故答案为:增大;
(3)电池总反应为:H2SO4+Fe=FeSO4+H2↑,n(H2SO4)=n(H2)=$\frac{3.36L}{22.4L/mol}$=0.15mol,
则:c(H2SO4)=$\frac{0.15mol}{0.2L}$=0.75mol/L,
A中是金属铁和硫酸能发生置换反应,进入的是铁,出去的是氢气,质量增重是54,B中Sn、Fe、硫酸构成的原电池,进入的是铁,出去的是氢气,质量增重是54,C中Zn、Fe、硫酸构成的原电池,进入的是锌,出去的是氢气,质量增重是63,原来三个溶液的质量相等,而溶液质量的变化等于进入和出去的物质的质量之差,所以三个烧杯中液体质量由大到小的顺序为:C>A=B,
故答案为:0.75; C>A=B;
(4)电化学腐蚀的速率大于化学腐蚀的速率,金属做原电池正极时得到保护,腐蚀速率最小,故答案为:BAC.
点评 本题考查金属的电化学腐蚀与防护,题目难度不大,注意金属的电化学腐蚀与化学腐蚀的区别,以及比较金属腐蚀快慢的方法.

| A. | 全球禁用氟里昂是为了保护臭氧层不被破坏 | |
| B. | 误食重金属盐,可用喝牛奶或生鸡蛋清进行解毒 | |
| C. | 苯酚有毒,但它的稀溶液可直接用作防腐剂和消毒剂 | |
| D. | 变质的花生油有难闻的特殊气味,是由于油脂发生了水解反应 |
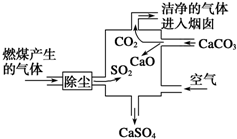
| A. | 进入烟囱的气体为混合物 | |
| B. | 此过程中硫元素的化合价没有发生改变 | |
| C. | 使用此废气处理装置可减少酸雨的形成 | |
| D. | 整个过程的反应可表示为2SO2+2CaCO3+O2═2CaSO4+2CO2 |
①把工厂烟囱造高 ②燃料脱硫 ③开发洁净能源 ④在酸化土壤中加入石灰⑤用煤作燃料.
| A. | ①②⑤ | B. | ①②③④ | C. | ②③ | D. | ②④⑤ |
| A. | 6:1 | B. | 2:1 | C. | 1:2 | D. | 9:1 |
| A. | 侯德榜提出的联合制碱法可大大提高氯化钠的利用率 | |
| B. | 具有永久硬度的硬水可以采用加热的方法进行软化 | |
| C. | CO.CH4、CH3OH是一碳化学的主要原料 | |
| D. | 复合材料一般由起黏结作用的基体和起增强作用的增强体构成 | |
| E. | 油脂和氢氧化钠共热产生的混合物,加入食盐可使肥皂析出. |
| A. | SO2和CO2都是酸性氧化物,SO2与Na2O2反应生成Na2SO3和O2 | |
| B. | 84 g NaHCO3受热分解,将生成的气体通过足量的Na2O2,固体质量增加31 g | |
| C. | 将Na2O2投入到酚酞试液中,溶液变红 | |
| D. | Na2O2与水的反应中,Na2O2既是氧化剂,又是还原剂 |
| A. | 溶液由黄色变为浅绿色 | B. | 溶液由浅绿色变为黄色 | ||
| C. | 溶液由浅绿色变为血红色 | D. | 有气体产生 |
| 选项 | 被提纯的物质(杂质) | 除杂试剂 | 分离方法 |
| A | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| B | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 分液 |
| C | 乙醇(乙酸) | 新制生石灰 | 蒸馏 |
| D | 甲苯(苯酚) | 浓溴水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |