题目内容
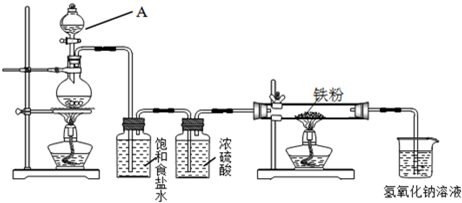
(10分)瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体——氯气。某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题: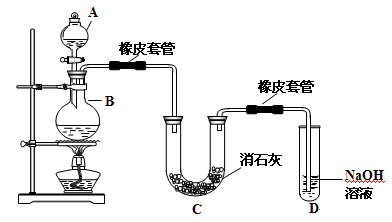
(1)A仪器的名称是 ,所盛试剂是 。
(2)漂白粉将在U形管中产生,其化学方程式是 。
(3)此实验结果所得Ca(ClO)2产率太低。经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
① 温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是 。
② 试判断另一个副反应(写出此反应方程式): 。
(4)2005年以来,淮安、无锡等地发生重大液氯泄漏事故。某城市以“液氯泄漏”作为应急预警演习的项目,演习时下列处理措施不合理的是 (请填写序号 )。
① 人员就近向地下商场或地铁转移
② 及时用毛巾包裹活性炭捂住口鼻
③ 及时戴上用烧碱溶液湿润过的口罩
④ 液氯罐中的液氯泄漏时,可将其移入新开挖的坑塘中,并加入生石灰
(10分)(1)分液漏斗(1分浓盐酸(1分)
(2)2Cl2 + 2 Ca(OH)2=CaCl2 + Ca(ClO)2 + 2H2O(2分)(3)① 冰水冷却(2分)
② 2HCl + Ca(OH)2 =CaCl2 + 2H2O(2分) (4)①③(2分)
解析试题分析:(1)根据仪器的构造特点可知,A仪器的名称是分液漏斗,里面盛有浓盐酸。
(2)工业制取漂白粉的原理是2Cl2 + 2 Ca(OH)2=CaCl2 + Ca(ClO)2 + 2H2O。
(3)① 温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,所以应该降低温度,即采取的措施是将装置置于冰水中冷却。
②由于生成的氯气中含有氯化氢杂质,所以另一个副反应是2HCl + Ca(OH)2 =CaCl2 + 2H2O。
(4)氯气的密度大于空气的,所以应该向高处转移,①不正确;烧碱具有强烈的腐蚀性,③不正确,应该用肥皂水,其余措施都是正确的,答案选①③。
考点:考查氯气的制备、仪器的识别、漂白粉的制备以及氯气泄露的处理
点评:该题是中等难度的试题,试题基础性强,难易适中,注重基础和能力的双向考查,有利于培养学生分析问题、灵活运用基础知识解决实际问题的能力,也有助于培养学生的安全防范意识和环境保护意识。

 名校课堂系列答案
名校课堂系列答案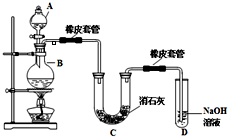 瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
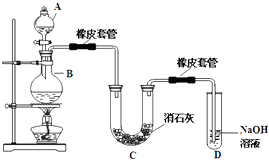 瑞典化学家舍勒在研究软锰矿(主要成分是 MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
瑞典化学家舍勒在研究软锰矿(主要成分是 MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题: