题目内容
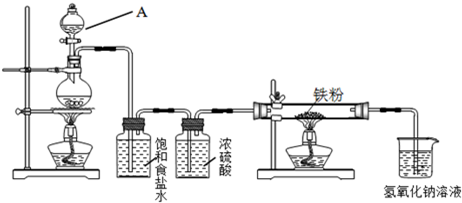
瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:

(1)A仪器的名称是
(2)漂白粉将在U形管中产生,其化学方程式是
(3)此实验结果所得Ca(ClO)2产率太低.经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是
②试判断另一个副反应(写出此反应方程式):
(4)漂粉精同盐酸作用产生氯气:Ca(ClO)2+4HCl=2Cl2↑+CaCl2+2H2O,该反应中每生成1 mol Cl2,转移电子的物质的量为

(1)A仪器的名称是
分液漏斗
分液漏斗
,所盛试剂是浓盐酸
浓盐酸
,B中发生反应的化学方程式是MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑
| ||
MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑
.
| ||
(2)漂白粉将在U形管中产生,其化学方程式是
2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O
2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O
.(3)此实验结果所得Ca(ClO)2产率太低.经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是
将U形管置于冷水浴中
将U形管置于冷水浴中
.②试判断另一个副反应(写出此反应方程式):
2HCl+Ca(OH)2=CaCl2+2H2O
2HCl+Ca(OH)2=CaCl2+2H2O
.为避免此副反应发生,应采取的措施是在B、C之间增加一个饱和食盐水洗气装置
在B、C之间增加一个饱和食盐水洗气装置
.(4)漂粉精同盐酸作用产生氯气:Ca(ClO)2+4HCl=2Cl2↑+CaCl2+2H2O,该反应中每生成1 mol Cl2,转移电子的物质的量为
1
1
mol,被氧化的HCl的物质的量为1
1
mol.有效氯是漂粉精中有效Ca(ClO)2 的含量大小的标志.已知:有效氯=(漂粉精加盐酸所释放出的氯气的质量/漂粉精的质量)×100%,该漂粉精的有效氯为65%,则该漂粉精中Ca(ClO)2的质量分数为65.5%
65.5%
(保留一位小数).分析:(1)A仪器名称是分液漏斗,所盛放试剂是液体浓盐酸,加热条件下,浓盐酸和二氧化锰发生氧化还原反应;
(2)氯气和消石灰反应生成氯化钙、次氯酸钙和水;
(3)①因为温度高时易生成Ca(ClO3)2,所以避免此反应发生可以采取降温措施;
②装置中无氯气的除杂装置,挥发出的氯化氢会和氢氧化钙反应;
(4)根据化合价变化计算转移电子的物质的量,根据原子守恒计算被氧化的氯化氢的量,根据氯气和漂白精之间的关系进行计算.
(2)氯气和消石灰反应生成氯化钙、次氯酸钙和水;
(3)①因为温度高时易生成Ca(ClO3)2,所以避免此反应发生可以采取降温措施;
②装置中无氯气的除杂装置,挥发出的氯化氢会和氢氧化钙反应;
(4)根据化合价变化计算转移电子的物质的量,根据原子守恒计算被氧化的氯化氢的量,根据氯气和漂白精之间的关系进行计算.
解答:解:(1)装置中添加浓盐酸通过分液漏斗,所以A仪器名称是分液漏斗,加热条件下,浓盐酸和二氧化锰反应生成氯化锰、氯气和水,反应方程式为:MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑,
故答案为:分液漏斗;浓盐酸;MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑;
(2)漂白粉将在U形管中产生,是氯气和氢氧化钙反应生成氯化钙、次氯酸钙、水;其化学方程式为:2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O;
故答案为:2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O;
(3)①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,将U形管置于冷水浴中;
②置中无氯气的除杂装置,挥发出的氯化氢会和氢氧化钙反应,反应的化学方程式为:2HCl+Ca(OH)2=CaCl2+2H2O,为避免此副反应发生,应采取的措施是在B、C之间增加一个饱和食盐水洗气装置,
故答案为:将U形管置于冷水浴中;2HCl+Ca(OH)2=CaCl2+2H2O;在B、C之间增加一个饱和食盐水洗气装置;
(4)该反应中每生成1 mol Cl2,转移电子的物质的量=1mol×(1-0)×1=1mol,根据原子守恒知,被氧化的HCl的物质的量为1mol,
Ca(ClO)2+4HCl=2Cl2↑+CaCl2+2H2O,根据方程式可以得到漂白精加盐酸所释放的氯气的质量=
×
m[Ca(ClO)2]=99.3%×m[Ca(ClO)2],所以漂白精的质量=
×m[Ca(ClO)2]=152.8%×m[Ca(ClO)2],所以该漂粉精中Ca(ClO)2的质量分数=
=65.5%,
故答案为:1;1;65.5%.
| ||
故答案为:分液漏斗;浓盐酸;MnO2+4HCl(浓)
| ||
(2)漂白粉将在U形管中产生,是氯气和氢氧化钙反应生成氯化钙、次氯酸钙、水;其化学方程式为:2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O;
故答案为:2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O;
(3)①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,将U形管置于冷水浴中;
②置中无氯气的除杂装置,挥发出的氯化氢会和氢氧化钙反应,反应的化学方程式为:2HCl+Ca(OH)2=CaCl2+2H2O,为避免此副反应发生,应采取的措施是在B、C之间增加一个饱和食盐水洗气装置,
故答案为:将U形管置于冷水浴中;2HCl+Ca(OH)2=CaCl2+2H2O;在B、C之间增加一个饱和食盐水洗气装置;
(4)该反应中每生成1 mol Cl2,转移电子的物质的量=1mol×(1-0)×1=1mol,根据原子守恒知,被氧化的HCl的物质的量为1mol,
Ca(ClO)2+4HCl=2Cl2↑+CaCl2+2H2O,根据方程式可以得到漂白精加盐酸所释放的氯气的质量=
| 71×2 |
| 143 |
m[Ca(ClO)2]=99.3%×m[Ca(ClO)2],所以漂白精的质量=
| 99.3% |
| 65% |
| 1 |
| 152.8% |
故答案为:1;1;65.5%.
点评:本题考查了氯气的有关知识,难度较大,注意有效氯的计算方法,为解题难点.

练习册系列答案
相关题目
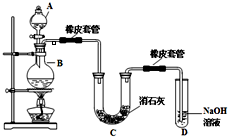 瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题: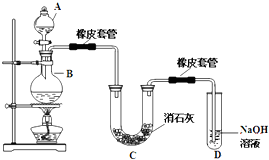 瑞典化学家舍勒在研究软锰矿(主要成分是 MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
瑞典化学家舍勒在研究软锰矿(主要成分是 MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题: