题目内容
一定条件下,用甲烷可以消除氮的氧化物(NOx)的污染,已知:
①CH4(g)+4NO2(g) =4NO(g)+CO2(g)+2H2O(g) ΔH1=-574kJ·mol-1
②CH4(g)+4NO(g) =2N2(g)+CO2(g)+2H2O(g) ΔH2=-1160kJ·mol-1
下列选项正确的是
- A.CH4(g)+2NO2(g) =N2(g)+CO2(g)+2H2O(g)ΔH=-867kJ·mol-1
- B.CH4(g)+4NO2(g) =4NO(g)+CO2(g)+2H2O(l)ΔH3>ΔH1
- C.若用0.2mol CH4还原NO2至N2,则反应中放出的热量一定为173.4kJ
- D.若用标准状况下2.24L CH4还原NO2至N2,整个过程中转移的电子为1.6mol
A
A中依盖斯定律,由(①+②)÷2得:CH4(g)+2NO2(g) =N2(g)+CO2(g)+2H2O(g) ΔH=(ΔH1+ΔH2)÷2=-867kJ·mol-1;B中由于H2O(g) =H2O(l) ΔH4<0,依盖斯定律知ΔH3=ΔH1+2ΔH4,故ΔH3<ΔH1;C中0.2mol CH4与NO2反应生成H2O(g)时放出173.4kJ,若生成H2O(l),则放出的热量大于173.4kJ;D中反应CH4+4NO2=N2+CO2+2H2O1molCH4中转移的电子数为8e-,故0.1molCH4参加反应时转移的电子为0.8mol。
A中依盖斯定律,由(①+②)÷2得:CH4(g)+2NO2(g) =N2(g)+CO2(g)+2H2O(g) ΔH=(ΔH1+ΔH2)÷2=-867kJ·mol-1;B中由于H2O(g) =H2O(l) ΔH4<0,依盖斯定律知ΔH3=ΔH1+2ΔH4,故ΔH3<ΔH1;C中0.2mol CH4与NO2反应生成H2O(g)时放出173.4kJ,若生成H2O(l),则放出的热量大于173.4kJ;D中反应CH4+4NO2=N2+CO2+2H2O1molCH4中转移的电子数为8e-,故0.1molCH4参加反应时转移的电子为0.8mol。

练习册系列答案
相关题目
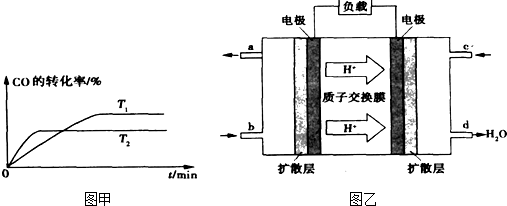
 );尿素在尿素酶的催化下跟水反应可生成碳酸铵,被作物吸收。
);尿素在尿素酶的催化下跟水反应可生成碳酸铵,被作物吸收。 );尿素在尿素酶的催化下跟水反应可生成碳酸铵,被作物吸收。
);尿素在尿素酶的催化下跟水反应可生成碳酸铵,被作物吸收。