题目内容
一定条件下,用甲烷可以消除氮氧化物(NOx)的污染.已知:
①CH4 (g)+4NO2 (g)=4NO (g)+CO2 (g)+2H2O (g)△H=-574kJ?mol-1
②CH4 (g)+4NO (g)=2N2 (g)+CO2 (g)+2H2O (g)△H=-1160kJ?mol-1
下列选项正确的是( )
①CH4 (g)+4NO2 (g)=4NO (g)+CO2 (g)+2H2O (g)△H=-574kJ?mol-1
②CH4 (g)+4NO (g)=2N2 (g)+CO2 (g)+2H2O (g)△H=-1160kJ?mol-1
下列选项正确的是( )
分析:A、由反应①+②可得到2CH4(g)+4NO2(g)═2N2(g)+2CO2(g)+4H2O( g ),再利用化学计量数与反应热成正比来计算;
B、根据物质的量之比等于热量比,结合方程式求出热量;
C、氮氧化物转化为N2,N2是无毒的气体;
D、利用n=
计算甲烷的物质的量,再利用碳元素化合价的变化来计算转移的电子数.
B、根据物质的量之比等于热量比,结合方程式求出热量;
C、氮氧化物转化为N2,N2是无毒的气体;
D、利用n=
| V |
| Vm |
解答:解:A、反应①+②可得到2CH4(g)+4NO2(g)═2N2(g)+2CO2(g)+4H2O( g ),△H=(-574kJ?mol-1)+(-1160kJ?mol-1)=-1734kJ?mol-1,
则CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O( g )△H=-867kJ?mol-1,若生成液态水,则放出的热量大于867KJ,故A错误;
B、由CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O( g )△H=-867kJ?mol-1,放出的热量为0.2mol×867kJ?mol-1=173.4kJ,故B正确;
C、通过将氮氧化物转化为N2,N2是无毒的气体,能消除污染,与N2参与大气循环无关,故C错误;
D、甲烷的物质的量为
=0.1mol,碳元素的化合价由-4价升高为+4价,则转移的电子总数为为0.1mol×8=0.8mol,故D错误;
故选B.
则CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O( g )△H=-867kJ?mol-1,若生成液态水,则放出的热量大于867KJ,故A错误;
B、由CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O( g )△H=-867kJ?mol-1,放出的热量为0.2mol×867kJ?mol-1=173.4kJ,故B正确;
C、通过将氮氧化物转化为N2,N2是无毒的气体,能消除污染,与N2参与大气循环无关,故C错误;
D、甲烷的物质的量为
| 2.24L |
| 22.4L/mol |
故选B.
点评:本题考查学生利用盖斯定律来计算反应的反应热,并学会利用化学计量数与反应热的关系、利用化合价的变化分析电子转移的数目来就解答即可.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
 );尿素在尿素酶的催化下跟水反应可生成碳酸铵,被作物吸收。
);尿素在尿素酶的催化下跟水反应可生成碳酸铵,被作物吸收。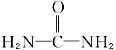 );尿素在尿素酶的催化下跟水反应可生成碳酸铵,被作物吸收。
);尿素在尿素酶的催化下跟水反应可生成碳酸铵,被作物吸收。