题目内容
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程,下列有关说法正确的是
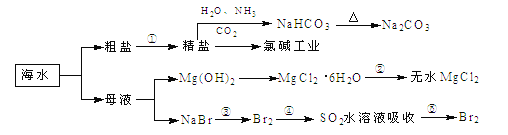
A. 制取NaHCO3的反应是利用其溶解度小于NaCl和NH4Cl
B. ①粗盐提纯中除去杂质离子Mg2+、Ca2+、SO42-时,必须先除Ca2+后除SO42-
C. 在工段③、④、⑤中,溴元素均被氧化
D. 工业上通过电解饱和MgCl2溶液制取金属镁
【答案】A
【解析】
A项,“侯氏制碱法”的基本原理是:在浓氨水中通入足量的二氧化碳,生成碳酸氢铵溶液,然后在此盐溶液中加入细的食盐粉末,碳酸氢钠由于在该状态下溶解度很小,呈晶体析出,析出的碳酸氢钠加热分解即可制得纯碱;B项,粗盐溶于水,加入氢氧化钠溶液除去镁离子,再加入氯化钡溶液,除去硫酸根离子,最后加碳酸钠溶液除去钙离子和钡离子;或者粗盐溶于水,先加氯化钡溶液,除去硫酸根离子,再加入氢氧化钠溶液除去镁离子,最后加碳酸钠溶液,除去钙离子和钡离子;C项,第④步骤,Br2+SO2+2H2O=2HBr+H2SO4,溴元素被还原;D项,工业上通过电解熔融状态的MgCl2制取金属镁。
A项,“侯氏制碱法”中发生NH3+CO2+NaCl+H2O=NH4Cl+ NaHCO3反应,是利用NaHCO3的溶解度比较小的规律,故A项正确;B项,粗盐溶于水,先加入氢氧化钠溶液、再加氯化钡溶液、最后加碳酸钠溶液,先后除去Mg2+、SO42- 、Ca2+;或先加氯化钡溶液、加入氢氧化钠溶液、最后加碳酸钠溶液,先后除去SO42-、Mg2+、Ca2+;所以没有先后之分,故B项错误;C项,第③、⑤步骤,溴元素被氧化,第④步骤,Br2+SO2+2H2O=2HBr+H2SO4,溴元素被还原,故C项错误;D项,电解饱和MgCl2溶液制得的是Cl2和H2,工业上通过电解熔融状态的MgCl2制取金属镁,故D项错误;正确选项A。

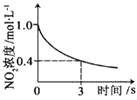
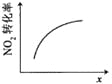
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A | B | C | D |
|
|
|
|
升高温度, | 0~3s内,反应速率为: | t1时仅加入催化剂, | 达平衡时,仅改变x,则x为c(O2) |