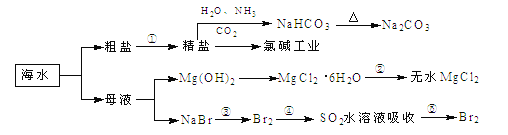
题目内容
【题目】过氧化氢(H2O2)在医药、化工、民用等方面有广泛的应用。回答下面问题:
(1)最早制备H2O2使用的原料是易溶于水的BaO2和稀硫酸,发生反应的化学方程式是____。
(2)目前工业制备H2O2的主要方法是蒽醌法。反应流程如下:
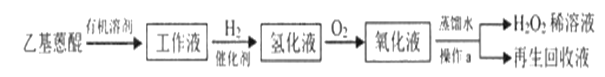
已知:乙基蒽醌是反应中的催化剂。
①蒽醌法所用原料的物质的量之比为____。
②操作a是____。
③再生回收液的成分是____。
(3)测量过氧化氢浓度常用的方法是滴定法,某次测定时,取20. 00mL过氧化氢样品,加入过量硫酸酸化,用0. l000mol/L的KMnO4标准溶液滴定至终点,消耗10. 00mL,滴定时发生反应的离子方程式为 ___,该样品中H2O2的物质的量浓度为______。
【答案】BaO2+H2SO4===BaSO4↓+H2O21:1萃取分液有机溶剂乙基蒽醌2MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O0.1250mol/L
【解析】
(l)易溶于水的BaO2和稀硫酸反应生成H2O2和BaSO4沉淀,发生反应的化学方程式是BaO2+H2SO4=BaSO4↓+H2O2;(2) ①根据反应原理可知,蒽醌法制备双氧水理论上消耗的原料是氧气和氢气,根据双氧水的化学式可知,原料的物质的量之比为1:1;②加入蒸馏水后进行操作a得到稀双氧水和再生回收液,根据流程原理再生回收液应该为乙基蒽醌,故操作是将乙基蒽醌从水中分离出来,应采用萃取分液;③再生回收液的成分是有机溶剂,乙基蒽醌;(3)双氧水在酸性条件下与KMnO4发生氧化还原反应,锰元素化合价由+7价降到+2价,O元素由-1价升高到0价,根据得失电子守恒、电荷守恒和原子守恒配平,滴定时发生反应的离子方程式为2MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O,根据反应可计算,样品中H2O2的物质的量浓度为![]() 。
。

 黄冈创优卷系列答案
黄冈创优卷系列答案