��Ŀ����
����Ŀ��ijС��ͬѧ�о�SO2��KI��Һ�ķ�Ӧ���������ʵ�顣
ʵ�� | ���� | ���� |
I |
| ��ҺѸ�ٱ�Ϊdz��ɫ������Һ�������ķ������������ ���������Һ������ɫ |
II |
| ��Һ����������ɫ������Һ�������ķ�����dz��ɫ�����������Һ��ɫ��dz�����������Һ������ɫ |
��1�����������Һ��Ŀ����______��Ϊ�ﵽ��ͬ��Ŀ�ģ�����ѡ�õ��Լ���______��
��2�������飬II�е�dz��ɫ��������������ʾ�������������£�SO2��KI��Һ��Ӧ����S��I2��
�� �����������£�SO2��KI��Һ��Ӧ�����ӷ���ʽ��______��
�� ���II�м��������Һ����ɫ����ͬѧ������裺______��Ϊ֤ʵ�ü��裬��ͬѧȡII�����ķ�������Һ�����������ữ��BaCl2��Һ���а�ɫ�������ɡ�
�� ��ͬѧ��Ϊ��ͬѧ��ʵ�鷽����֧���������裬������______��
�� ��ͬѧ��1 mL 1 mol��L1 KCl��Һ�м���5��1 mol��L1���ᣬͨ��SO2��������ʵ�������ټ��������ữ��BaCl2��Һ������û�а�ɫ��������ͬѧ��ʵ�������______��
��3��ʵ�������I��SO2ת���Ĵ�������ȫ�������ӷ���ʽ��
SO2��H2O ===_____ �� ��
��4���Ա�ʵ��I��II���Ʋ�����H+��Ũ�ȿɼӿ�SO2��ת�����ʡ�Ϊ֤ʵ���Ʋ⣬�����һ������ʵ��֤����ʵ�鷽����______��
���𰸡������Ƿ���I2���� CCl4������ú�ͣ� SO2 +4I +4H+ == 2I2 +S+2H2O SO2��I2��ԭΪI �����е�O2��SO2����ΪSO42 O2����SO2����ΪSO42����Ҫԭ�� 3SO2+2H2O === 4H++ 2SO42 +S ��1 mL 1 mol��L1 KI��Һ�м��� 5��1 mol��L1 KCl��Һ����ͨ�� SO2���壬�۲�����
��������
��1������������Һ��ɫ�����������л��ܼ����ҵ�����Ȼ�̼��Һ���Ϻ�ɫ��
��2�������飬II�е�dz��ɫ��������������ʾ�������������£�SO2��KI��Һ��Ӧ����
�������������£�SO2��KI��Һ��ӦS��I2������غ㷨д��������Ӧ�����ӷ���ʽ��
�����ķ�������Һ�����������ữ��BaCl2��Һ���а�ɫ�������ɣ�˵����Һ����SO42-��˵��I2������SO2����SO42-��
�ۿ�������������Ҳ������SO2��
�ܼ��������ữ��BaCl2��Һ������û�а�ɫ������˵����Һ����SO42-��
��3��I��SO2ת���Ĵ�������֪SO2�ڷ�Ӧ�мȱ���������SO42-���ֱ���ԭ����S������غ㷨��ƽ���ӷ�Ӧ����ʽ��
��4��ͨ���ı�H+��Ũ�����ж�SO2��ת�������Ƿ����ı䣻
��1�����õ���������Һ��ɫ�����������Һ�ɼ��鷴Ӧ���е����ɣ����������л��ܼ���Ҳ���Լ���CCl4�����ã����л����Ƿ����Ϻ�ɫ�����жϷ�Ӧ���е����ɣ�
��2���������������£�SO2��KI��Һ��ӦS��I2��������Ӧ�����ӷ���ʽΪSO2 +4I +4H+ == 2I2 +S+2H2O��
��II�м��������Һ����ɫ��˵��I2����ԭ�����SO2���л�ԭ�ԣ��ɼ���SO2��I2��ԭΪI��
����ͬѧ��Ϊ��������������Ҳ�ܽ�SO2����ΪSO42���ʲ�֧�ּ�ͬѧ���������裻
�ܼ��������ữ��BaCl2��Һ������û�а�ɫ������˵����Һ����SO42-���ɴ˿ɵó�O2����SO2����ΪSO42����Ҫԭ��
��3��I��SO2ת���Ĵ�������֪SO2�ڷ�Ӧ�мȱ���������SO42-���ֱ���ԭ����S��������Ӧ�����ӷ�Ӧ����ʽΪ3SO2+2H2O === 4H++ 2SO42 +S��
��4����1 mL 1 mol��L1 KI��Һ�м��� 5��1 mol��L1 KCl��Һ����ͨ�� SO2���壬�۲��������ж�����H+��Ũ���Ƿ�ɼӿ�SO2��ת�����ʡ�

����Ŀ����֪��һԪ����HA�ĵ���ƽ�ⳣ��K ��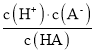 ��25��ʱ��CH3COOH��HCN��H2CO3�ĵ���ƽ�ⳣ�����£�
��25��ʱ��CH3COOH��HCN��H2CO3�ĵ���ƽ�ⳣ�����£�
��ѧʽ | CH3COOH | HCN | H2CO3 |
K | 1.75��10�C5 | 4.9��10�C10 | K1 = 4.4��10�C7 K2 = 5.6��10�C11 |
����˵����ȷ����
A. ϡ��CH3COOH��Һ�Ĺ����У�n(CH3COO�C)��С
B. NaHCO3��Һ�У�c(H2CO3) �� c(![]() ) �� c(HCO3)
) �� c(HCO3)
C. 25��ʱ����ͬ���ʵ���Ũ�ȵ�NaCN��Һ�ļ���ǿ��CH3COONa��Һ
D. ��CH3COOH��Һ��HCN��Һ�м���Na2CO3��Һ��������CO2