题目内容
【题目】六偏磷酸钠[(NaPO3)6]是偏磷酸钠(NaPO3)的一种聚合体,其主要用于水处理、造纸、食品行业。工业上由白磷(P4:易自燃,熔点44℃,沸点280℃,有剧毒,保存在冷水中)制备六偏磷酸钠的方法如下:
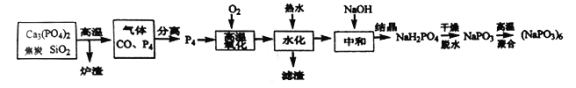
(1)“炉渣”的主要成分是___________(写化学式),该过程中氧化剂与还原剂的物质的量之比是_______________。
(2)从混合气体中分离得到P4的最佳方法是_________________。
(3)经分析“滤渣”是由白磷中的Pb、As杂质元素所形成的两种盐类,其中一种是Pb3(PO4)2,则另一种是_______________ (写化学式)。
(4)若直接将白磷与足量浓NaOH溶液直接混合加热,则得到的是次磷酸钠(NaH2PO2),但同时会得到一种剧毒气体。写出该化学方程式____________________。
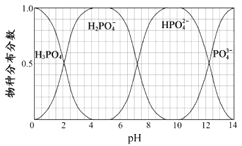
(5)已知磷酸中含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与溶液pH的关系如图所示,则“中和”过程中应加入NaOH调节溶液的pH值为________________。若pH过低,则造成的结果是_________________。
(6)经定量分析,毎100.00g产品的有效磷(以P2O5计)含量是66.50g (其它杂质为非磷酸盐成分),则该产品的纯度是__________________。(已知:NaPO3的相对分子质量为M1,P2O5的相对分子质量为M2,结果不必化简,列出计算式即可)
【答案】 CaSiO3 1:5 将混合气体通入冷水中,过滤 Pb3(AsO4)2 P4+3NaOH(浓)+ 3H2O![]() 3NaH2PO2+PH3↑ 5 (或5左右) pH过低,NaOH加入过少,H3PO4不能完全转化为NaH2PO4,磷元素利用低
3NaH2PO2+PH3↑ 5 (或5左右) pH过低,NaOH加入过少,H3PO4不能完全转化为NaH2PO4,磷元素利用低 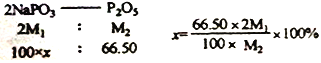
【解析】本题考查化学工艺流程,(1)根据流程图,Ca3(PO4)2、焦炭、SiO2反应生成CO和P4,根据元素守恒,因此炉渣的成分是CaSiO3;氧化剂Ca3(PO4)2,还原剂是焦炭,根据得失电子数目守恒,n[Ca3(PO4)2]×2×5=n(C)×2,即n[Ca3(PO4)2]:n(C)=1:5;(2)P4保存在冷水中,CO不溶于水,因此将混合气体通入冷水中,过滤;(3)因为生成两种盐,盐是由酸和碱发生中和反应生成,因此另一种盐为Pb3(AsO4)2;(4)P4转化成NaH2PO2,P的化合价升高,根据氧化还原反应的规律,还有P的化合价降低,产生有毒气体,即为PH3,反应式为P4+NaOH→NaH2PO2+PH3↑,利用化合价升降法,进行配平,即P4+3NaOH(浓)+ 3H2O![]() 3NaH2PO2+PH3↑;(5)根据流程,加入NaOH得到NaH2PO4,因此控制pH在5左右;根据图像,pH过低,主要以H3PO4的形式存在,不能全部转化成H2PO4-,磷元素利用较低;(6)令产品为100g,纯度为x,根据磷元素守恒,产品的纯度x=
3NaH2PO2+PH3↑;(5)根据流程,加入NaOH得到NaH2PO4,因此控制pH在5左右;根据图像,pH过低,主要以H3PO4的形式存在,不能全部转化成H2PO4-,磷元素利用较低;(6)令产品为100g,纯度为x,根据磷元素守恒,产品的纯度x=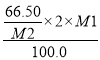 。
。

【题目】某研究性学习小组同学为了探究“在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子”,他们以教材中相关【科学探究】为基础,设计了如下实验装置并记录相关实验数据。
【实验装置】

【部分实验数据】
温度 | 压强 | 时间 | 水槽中H2O的质量 | H2体积 | O2体积 |
30 ℃ | 101 kPa | 0 | 300 g | 0 | 0 |
30 ℃ | 101 kPa | 4分钟 | 298.2 g | 1.243 L |
请回答下列问题:
(1)4分钟时H2、O2的物质的量分别是________mol、________mol。
(2)该温度下,气体摩尔体积是__________。
(3)下列叙述不正确的是________。
A.气体摩尔体积与气体的温度相关
B.在该实验条件下,3 mol O2的气体摩尔体积为74.58 L·mol-1
C.同温、同压下,2 mol CO、CO2混合气体和2 mol O2的体积相同
D.该实验条件下,O2的密度为1.287 g·L-1
