题目内容
【题目】硫化氢毒性很大,俗称“一口闷”,工业废水中的硫化物在酸性条件下会以硫化氢的形式逸出。某课外小组以碘量法测定废水中的硫化物,实验装置如图所示,实验步骤及测定原理如下:
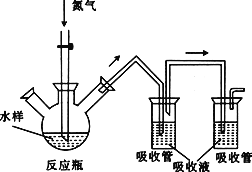
Ⅰ.取样、吹气、固硫
连接装置,打开氮气源,检查装置气密性。移取一定体积1mol·L-1乙酸锌溶液于两支吸收管中,取200mL水样于反应瓶中,通入氮气一段时间。移取10mL盐酸于反应瓶中,水浴加热,继续通入氮气。已知乙酸锌与硫化氢反应生成硫化锌沉淀(硫化氢被完全吸收)。
Ⅱ.滴定
关闭气源,往两个吸收管中各加入0.010mol·L-1的碘标准溶液100mL(过量),再加入盐酸5mL,静置。加入淀粉指示液,用0.010mol·L-1的硫代硫酸钠标准溶液对两支吸收管中的液体进行滴定。(已知:![]() )
)
回答下列问题:
(1)水浴加热的温度不能高于85℃,原因是_____________________________。
(2)加入碘标准溶液时,吸收管中发生反应的化学方程式为________________。
(3)该实验使用两个吸收管的原因是_____________________________,若只使用一个吸收管,会导致测定结果偏______________________(填“高”或“低”)。
(4)该200mL水样经吹气、固硫后,滴定操作时共消耗160mLNa2S2O3溶液,则废水中硫的含量为________mg·L-1。
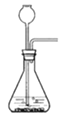
(5)实验室常用FeS固体与酸反应制取H2S。实验室制取H2S时,从反应物与生成物的状态、性质和反应条件分析,下列发生装置中可选用的是________(填序号)。

(6)将二氧化氯溶液加入硫化氢溶液中,然后加入少量稀盐酸酸化的氯化钡溶液,发现有白色沉淀生成。写出二氧化氯与硫化氢溶液反应的离子方程式:____。
【答案】温度太高,硫化氢逸出速率过快,导致不能被完全吸收(或其他合理答案) ZnS+I2=ZnI2+S 保证硫化氢被完全吸收 低 192 bc 5H2S+8ClO2+4H2O=18H++5SO42-+8Cl-
【解析】
硫化氢在反应瓶中制取,开始通入氮气一段时间,排净装置中的空气;水浴加热及充入氮气目的为排净反应瓶中生成硫化氢气体,硫化氢在吸收液中被完全吸收。在吸收管中发生:ZnS+I2=ZnI2+S,剩余的碘单质发生:![]() 。
。
(1)水浴加热温度过高,产生的气体流速过快,导致不能被完全吸收,答案为:温度太高,硫化氢逸出速率过快,导致不能被完全吸收(或其他合理答案);(2)在吸收管中发生:ZnS+I2=ZnI2+S;(3)使用两个吸收管的原因是:产生气体流速过快时,下一个吸收管能够吸收硫化氢气体,保证硫化氢被完全吸收;只使用一个,可能到硫化氢气体不能被完全吸收,结果偏低;(4)0.16L![]() 0.010mol/L:n(I2)=2:1,求得,剩余n(I2)=0.0008mol,共有碘单质:0.1L
0.010mol/L:n(I2)=2:1,求得,剩余n(I2)=0.0008mol,共有碘单质:0.1L![]() 0.010mol/L
0.010mol/L![]() 2=0.002mol,ZnS+I2=ZnI2+S,此反应消耗单质碘:0.0012mol,则n(S2-)=0.0012mol,废水中硫的含量=0.0012mol
2=0.002mol,ZnS+I2=ZnI2+S,此反应消耗单质碘:0.0012mol,则n(S2-)=0.0012mol,废水中硫的含量=0.0012mol![]() 32g/mol/0.2L=192mg/L;(5)FeS固体不溶于水,从节约环保的角度分析可用启普发生器或类似的装置,或可控的反应装置,故答案为:bc;(6)反应中有不溶于酸的白色沉淀生成,则生成BaSO4,根据化合价升降法配平,5H2S+8ClO2+4H2O=18H++5SO42-+8Cl-。
32g/mol/0.2L=192mg/L;(5)FeS固体不溶于水,从节约环保的角度分析可用启普发生器或类似的装置,或可控的反应装置,故答案为:bc;(6)反应中有不溶于酸的白色沉淀生成,则生成BaSO4,根据化合价升降法配平,5H2S+8ClO2+4H2O=18H++5SO42-+8Cl-。

【题目】在温度为T时,向2.0 L恒容密闭容器中充入1.0 molA和1.0 molB,发生反应A(g)+B(g)![]() C(g),一段时间后达到平衡。测定得部分数据见下表:
C(g),一段时间后达到平衡。测定得部分数据见下表:
t/s | 0 | 5 | 15 | 25 | 35 |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
(1)反应前5 s的平均反应速率v(A)=____________。
(2)温度为T时,达到平衡后B物质的量的浓度=________。
(3)升高温度,平衡时c(A)=0.41 mol·L-1,则反应的ΔH_______0(填“>”或“<”)。
(4)下列措施能增大反应速率,且平衡向正反应方向移动是__________。
a.及时分离出A气体 b.适当升高温度 c.增大B的浓度 d.选择高效催化剂