题目内容
| S 2O | 2-8 |
| -3 |
| 2SO | 2-4 |
(1)写出反应的平衡常数表达式K=______;
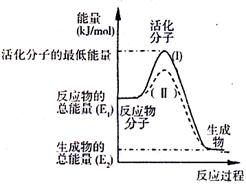
(2)如图表示反应过程中有关物质的能量,则反应的△H______0(填“>”、“<”或“=”);
(Ⅰ)、(Ⅱ)两线中,使用催化剂的是______线;
(3)反应中发生反应的I-与被氧化的I-的物质的量比为______;
(4)反应的速率可以用
| I | -3 |
| 实验编号 | ① | ② | ③ | ④ | ⑤ | ||
| c(I-)/mol?L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 | ||
c(
|
0.040 | 0.040 | 0.080 | 0.080 | 0.040 | ||
| t/s | 88 | 44 | 22 | 11 | t1 |

| S 2O | 2-8 |
| -3 |
| 2SO | 2-4 |
c
| ||||
c3(I-)?c
|
c
| ||||
c3(I-)?c
|
(2)由图可知,反应物的总能量高于生成物的总能量,该反应为放热反应,所以△H<0;
催化剂降低活化能,改变反应途径,提高反应速率,但不影响反应热,故(Ⅱ)表示使用催化剂,
故答案为:<;(Ⅱ);
(3)根据方程式可知,I3-可看做I2和I-相结合形成的微粒,故发生反应的I-与被氧化的I-的物质的量比为3:2,故答案为:3:2;
(4)由题目中表格数据可分析出c(I-)、c(S2O32-)浓度越大,反应速率越快,显蓝色所需时间越少,故实验目的应是研究反应物I-与S2O82-的浓度对反应速率的影响.
对比数据组①和②、③和④,可以看到,c (S2O82-)不变,c (I-)增大到2倍时,反应时间缩短了一半,即反应速率加快了一倍;
对比数据组②和③,可以看到,c (I-)不变,c (S2O82-)增大到2倍时,反应时间缩短了一半,即反应速率也加快了一倍;
对比数据组对比数据组①和③,可以看到,c (I-)和c (S2O82-)均增大到2倍时,反应时间为原反应时间的1/4,即反应速率加快了4倍.
可见两个反应物的浓度和反应速率之间的数学关系是:反应物浓度每增加一倍,反应时间就减少一倍,对于两个反应物来说都是如此,
可得出结论:反应速率与反应物起始浓度乘积成正比.
对比实验①和⑤,实验⑤的c (I-)为实验①的4倍,而c (S2O82-)保持不变,则由此可计算实验⑤的反应时间应为实验①反应时间的1/4,即t1=88s×
| 1 |
| 4 |
故答案为:研究反应物I-与S2O82-的浓度对反应速率的影响;22s;反应速率与反应物起始浓度乘积成正比.

 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案I、已知反应:
3I-(aq)+S2O82-(aq) ![]() I3-(aq)+2SO42-(aq);
I3-(aq)+2SO42-(aq);
(1)写出反应的平衡常数表达式
 K= 。
K= 。
(2)右图表示反应过程中有关物质的能量,则反应
的 △H 0(填>、<、=)。
(I)、(II)两线中,使用催化剂的是 线。
(3)反应中发生反应的I-与被氧化的I-的物质的量比为 。
(4)反应的速率可以用I3-与加入的淀粉溶液反应是蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,记录的数据如下:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol·L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c(S2O82-/mol·L-1) | 0.040 | 0.040 | 0.080 | 0.080 | 0.040 |
| t/s | 88 | 44 | 22 | 11 | t1 |
则:该实验的目的是
显色时间t1= s
分析表中数据,得出的结论是
II、二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) ![]() 2SO3(g)
2SO3(g)
某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如右图所示。
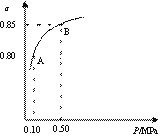 根据图示回答下列问题。
根据图示回答下列问题。
①平衡状态由A变到B时,平衡常数K(A) K(B)
(填“>”、“<”、“=”)。
②已知上述反应的是放热反应,当该反应处于平衡状态时,
在体积不变的条件下,下列选项中有利于提高SO2平衡转
化率的有 (填字母)。
A.升高温度 B.降低温度 C.增大压强 D.减小压强
E.加入催化剂 F.移出氧气

 TiCl4(1)+O2(g) △H=+151 kJ/mol。所以不能直接由TiO2和Cl2反应(即氯化反应)来制取TiCl4,请说明判断该反应难以发生的理由是_______。当往氯化反应体系中加入碳后,反应在高温条件下能顺利进行生成TiCl4。
TiCl4(1)+O2(g) △H=+151 kJ/mol。所以不能直接由TiO2和Cl2反应(即氯化反应)来制取TiCl4,请说明判断该反应难以发生的理由是_______。当往氯化反应体系中加入碳后,反应在高温条件下能顺利进行生成TiCl4。 394
kJ/mol。
394
kJ/mol。
 TiO2/S*
(激发态)
TiO2/S*
(激发态) TiO2/S+
+ e-
TiO2/S+
+ e-